2.1. Химическая связь и валентность
Как правило, в межатомных
связях у большинства элементов принимают участие все внешние валентные электроны. У Cu, Ag, Au, Eu, Am вследствие сравнительно
небольшой энергии связи электронов заполненных ![]() ,
, ![]() ,
, ![]() оболочек в межатомных
связях могут дополнительно участвовать один-два электрона этих оболочек.
Существует ряд элементов, имеющих большое число валентных электронов во внешней
оболочке, но из-за их высоких энергий связи с атомом не все валентные электроны
могут участвовать в межатомных связях. Это атомы таких элементов, как кислород,
фтор, железо, кобальт, никель, и др.
оболочек в межатомных
связях могут дополнительно участвовать один-два электрона этих оболочек.
Существует ряд элементов, имеющих большое число валентных электронов во внешней
оболочке, но из-за их высоких энергий связи с атомом не все валентные электроны
могут участвовать в межатомных связях. Это атомы таких элементов, как кислород,
фтор, железо, кобальт, никель, и др.
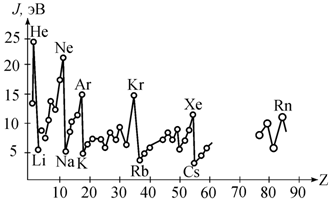
Число валентных электронов, способных участвовать в образовании межатомных связей, периодически изменяется с возрастанием атомного номера Z, что является следствием периодического закона Менделеева. Одной из важнейших характеристик химических элементов служит величина потенциала ионизации J. В частности, первый потенциал ионизации соответствует энергии, необходимой для отрыва электрона от нейтрального невозбужденного атома. На рис. 2.1 приведена зависимость первого потенциала ионизации J от атомного номера.
|
|
|
Рис. 2.1. Зависимость первого потенциала ионизации от порядкового
номера элемента в таблице Менделеева [78] |
Видно, что зависимость носит явный периодический характер. Щелочные металлы − литий, натрий, калий, рубидий, цезий (Li, Na, K, Rb, Cs) имеют по сравнению с другими элементами минимальные потенциалы ионизации (5,4; 5,16; 4,18; 3,9 эВ соответственно), поскольку у них имеется лишь один валентный электрон, который относительно слабо связан с ядром атома. В результате этого атомы щелочных металлов в различных реакциях легко отдают внешний электрон, образуя при этом положительно заряженные ионы: Li+, Na+, K+, Rb+, Cs+. Интересно, что после отрыва валентного электрона электронные оболочки ионов имеют такую же конфигурацию, как у инертных газов (He, Ne, Ar, Kr, Xe, Rn), которые находятся в устойчивом состоянии и первый потенциал ионизации для которых очень велик (рис. 2.1).
Перед инертными газами в таблице Менделеева располагаются галогены (элементы VII группы периодической системы). Первый потенциал ионизации у них находится в пределах 10−18 эВ. Например, фтор, хлор, бром, йод (F, Cl, Br, J), у которых не хватает одного электрона для образования устойчивых электронных оболочек ближайших к ним атомов инертных газов, вследствие этого легко присоединяют к себе электрон, образуя соответствующие отрицательные ионы – анионы: F-, Cl-, Br-, J-. Энергию Э, освобождающуюся при присоединении электрона к нейтральному невозбужденному атому с образованием аниона, называют энергией сродства атома к электрону. Наибольшим сродством к электрону обладают атомы галогенов: F – 3,4 эВ, Cl – 3,6 эВ, Br – 3,4 эВ, J – 3,1 эВ. С понятиями потенциала ионизации и энергии сродства к электрону тесно связана ионная валентность, определяемая как число электронов, которое может терять или приобретать атом. Щелочные металлы положительно одновалентны, поскольку они содержат на один электрон больше, чем атомы соответствующих ближайших инертных элементов, например ионная валентность атома Na равна +1. Атомы галоидов отрицательно одновалентны, у них не хватает одного электрона для образования устойчивой оболочки ближайших атомов инертных газов. Так, для атома Cl ионная валентность равна -1.
Аналогично атомы II группы, теряя два электрона, могут также образовывать ионы с электронной структурой ближайших атомов инертных газов: Be2+, Mg2+, Ca2+, Sr2+, и, следовательно, эти атомы обладают положительной валентностью, равной +2; атомы III группы, теряя три электрона, могут образовывать ионы с валентностью +3 и т. д.
При взаимодействии атомов одного сорта с атомами другого сорта характер химической связи определяется их способностью захватывать или отдавать валентный электрон. Эта способность характеризуется электроотрицательностью атомов X. Электроотрицательность – параметр, выражающий тенденцию атома притягивать к себе электроны. Электроотрицательность не является строго физической величиной, т. к. она не постоянна и зависит от природы другого атома, с которым химически связан данный атом. Один и тот же атом в химической связи иногда одновременно может выступать и как электроположительный, и как электроотрицательный. Однако электроотрицательность очень слабо зависит от типа связи и от конкретных особенностей кристаллической структуры, что делает ее некоторым объективным параметром атомов, который полезен при обсуждении свойств твердых тел.
За приближенное значение электроотрицательности атома обычно принимают среднее арифметическое первого ионизационного потенциала и энергии сродства к электрону:
|
|
(2.1) |
Все элементы периодической таблицы Менделеева можно расположить в ряд по значению электроотрицательности. Из табл. 2.1 [78] видно, что значения электроотрицательности изменяются от 0,7 эВ для цезия Cs до 4 эВ для фтора F. Каждый период периодической таблицы начинается с наиболее электроположительных элементов, т. е. наиболее склонных к образованию положительных ионов (щелочные металлы, имеющие малые энергии ионизации и малые энергии сродства к электрону). На другом конце каждого ряда располагают наиболее электроотрицательные элементы, т. е. такие, которые наиболее легко образуют отрицательные ионы (галогены, обладающие большими потенциалами ионизации и значительным сродством к электрону). Таким образом, в левой части таблицы располагаются элементы с наиболее сильно выраженными металлическими свойствами (металлы), а в правой – элементы с наиболее сильно выраженными неметаллическими свойствами (металлоиды).
Таблица 2.1
Значения электроотрицательности X
для некоторых элементов таблицы Менделеева
|
Период |
Элемент (X, эВ) |
||||||
|
1 |
H |
||||||
|
Li |
Be |
B |
C |
N |
O |
F |
|
|
2 |
Na |
Mg (1,2) |
Al |
Si |
P |
S |
Cl |
|
3 |
K |
Ca |
Sc |
Ge |
As |
Se |
Br |
|
4 |
Rb |
Sr |
V |
Sn |
Sb |
Te |
I (2,5) |
|
5 |
Cs |
Ba |
|
|
|
|
At |
В таблице можно условно провести границу между металлами и металлоидами. Эта граница проходит по химическим признакам. Одним из таких признаков является то, что в водных растворах типа солей происходит ионная диссоциация, в результате которой в растворе появляются гидратированные положительные ионы (катионы) металла (Na+, Mg2+, …), а также отрицательные ионы (анионы) металлоида (Cl-, S2-, …).
Разделение химически активных элементов на металлы и металлоиды позволяет ввести три основных типа связи: металлическая, ковалентная и ионная. Связь между сильно электроположительными металлами и электроотрицательными неметаллами трактуется как ионная связь. Поскольку она осуществляется между противоположно заряженными ионами, то ее называют – по полярности ионов – гетерополярной. К гомополярным относят металлическую и ковалентную связи. Металлическая связь реализуется между атомами металлов, а ковалентная – между атомами неметаллов, или металлоидов. Названные типы связей являются предельными случаями химического взаимодействия. В реальной ситуации ковалентные связи в чистом виде редко реализуются и имеют в какой-то мере частично ионный характер. Соединений, близких к идеально ионным, также чрезвычайно мало.
Одним из экспериментальных подтверждений того, что ионная связь в кристаллах должна рассматриваться лишь как предельный случай частично ионной связи, является тот факт, что эффективный заряд атома, входящего в состав того или иного соединения, определяемый как алгебраическая сумма отрицательного заряда его электронов и положительного заряда ядра, как правило, не равен целому числу зарядов электрона е (табл. 2.2 [78]).
Таблица 2.2
Эффективные заряды атомов в некоторых
соединениях
|
Соединение |
Эффективный заряд |
|
|
NaCl |
+0,92e (для Na) |
|
|
NaBr |
+0,83e (для Na) |
|
|
SiO2 |
+1,97e (для Si), |
-0,99e (для O) |
|
Na2S |
+0,75e (для Na), |
-0,96e (для S) |
|
ZnS |
|
-0,86e (для S) |
Как видно из табл. 2.2, один и тот же элемент в разных соединениях имеет различные эффективные заряды. Например, в NaCl эффективный заряд атома Na равен +0,92е, а в NaBr составляет +0,83е. По-видимому, при взаимодействии происходит перераспределение зарядов между атомами до тех пор, пока разность электроотрицательностей не станет равной нулю. Поскольку один и тот же атом может вступать во взаимодействие с различными атомами, каждый из которых имеет свою электроотрицательность, то и эффективные заряды рассматриваемого атома в различных соединениях различны.