1.6. Примеры простых кристаллических структур
Структура кристалла − это конкретное расположение частиц в пространстве. Описывая структуру, необходимо указать вид и размер частиц, а также расстояния между ними. Если вещества кристаллизуются в сходных друг с другом решетках, то говорят, что они относятся к одному структурному типу. У кристаллов, принадлежащих к одному структурному типу, элементарные ячейки одинаковы с точностью до подобия. Опишем некоторые наиболее часто встречающиеся структурные типы [27, 83].
Опытные данные показывают, что почти 80 % металлов кристаллизуются в объемно- и гранецентрированных кубических, а также в гексагональных плотноупакованных решетках.
Металлы с ГЦК решеткой, относятся к структурному типу меди. К ним относятся,
например, золото, серебро, никель, алюминий, кальций, свинец, a-кобальт и др. Все эти металлы сравнительно мягкие,
пластичные, легко обрабатываются. Структурой типа меди обладают некоторые
твердые растворы, например твердый раствор меди в золоте (Cu−Au), а также многие так называемые
интерметаллические соединения (AuSb, ZrH, TiH
и т. д.). Атомы в веществах со структурным типом меди располагаются в вершинах
и центрах граней куба с ребрами, равными по длине периоду элементарной ячейки.
На элементарную ячейку приходится 4 атома. Каждый атом окружен 12 ближайшими
атомами, т. е. координационное число ![]() . Структура характеризуется плотнейшей кубической трехслойной
упаковкой ABCABC…
. Структура характеризуется плотнейшей кубической трехслойной
упаковкой ABCABC…
ОЦК структура характерна для структурного типа вольфрама. К этому
типу, кроме самого вольфрама, относятся тугоплавкие металлы: хром, ванадий,
молибден, ниобий, тантал, b-кобальт, a-железо и другие. Атомы располагаются по вершинам и в
центре ячейки, т. е. на ячейку приходится 2 атома. Эта структура не относится к
плотно упакованным. Расстояния между атомами равны ![]() , где a −
период элементарной ячейки.
, где a −
период элементарной ячейки.
Другой структурный тип, характерный
для некоторых металлических кристаллов − тип магния. Элементарная ячейка магния гексагональная примитивная.
К структурному типу относятся, например кадмий, бериллий, таллий, титан, никель
и др., интерметаллические соединения, AgCd, AuCd,
CuCd3 и т.
д. Элементарная ячейка построена на трех трансляциях, две из которых лежат в
плотно упакованном слое атомов и составляют между собой угол ![]() , а третья перпендикулярна этому слою. В структуре магния на
элементарную ячейку приходится 2 атома магния. Каждый атом окружен 12
ближайшими атомами: 6 в том же слое и 3 в соседних слоях сверху и снизу.
Следовательно, координационное число, характерное для данного структурного
типа,
, а третья перпендикулярна этому слою. В структуре магния на
элементарную ячейку приходится 2 атома магния. Каждый атом окружен 12
ближайшими атомами: 6 в том же слое и 3 в соседних слоях сверху и снизу.
Следовательно, координационное число, характерное для данного структурного
типа, ![]() . В идеальных плотно упакованных гексагональных металлах
отношение высоты элементарной ячейки c к расстоянию a между соседними атомами равно 1,633, хотя сами периоды c и a для разных веществ различны.
. В идеальных плотно упакованных гексагональных металлах
отношение высоты элементарной ячейки c к расстоянию a между соседними атомами равно 1,633, хотя сами периоды c и a для разных веществ различны.
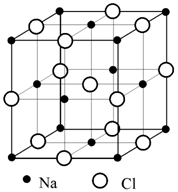
Многие щелочногалоидные кристаллы
относятся к структурному типу каменной
соли NaCl (рис. 1.19). Крупные ионы Cl (анионы) образуют кубическую
плотнейшую упаковку, в которой все октаэдрические пустоты заселены катионами
Na. Тетраэдрические пустоты не заполнены. Для структуры NaCl координационное
число ![]() для обоих сортов
атомов, т. е. каждый атом Na окружен 6 атомами Cl и наоборот.
для обоих сортов
атомов, т. е. каждый атом Na окружен 6 атомами Cl и наоборот.
|
|
|
Рис. 1.19.
Структура NaCl (каменной соли) |
Коэффициент упаковки в структуре NaCl ![]() %, т. е. около
половины объема ячейки приходится на пустоты между атомами. Период ячейки NaCl
%, т. е. около
половины объема ячейки приходится на пустоты между атомами. Период ячейки NaCl ![]() Å. Решетку такого типа можно рассматривать как
совокупность двух гранецентрированных решеток, смещенных друг относительно
друга на ½ пространственной диагонали куба, каждая из которых содержит
ионы лишь одного знака . Структурным типом NaCl характеризуются, например, окислы переходных элементов:
титана (TiO), железа (FeO), никеля (NiO).
Å. Решетку такого типа можно рассматривать как
совокупность двух гранецентрированных решеток, смещенных друг относительно
друга на ½ пространственной диагонали куба, каждая из которых содержит
ионы лишь одного знака . Структурным типом NaCl характеризуются, например, окислы переходных элементов:
титана (TiO), железа (FeO), никеля (NiO).
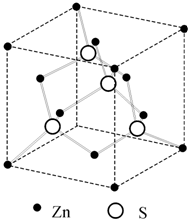
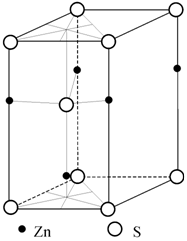
На рис. 1.20 и 1.21 изображена структура сульфида цинка ZnS. Этим структурным типом характеризуются многие бинарные соединения (например, арсенид галлия GaAs, окись цинка ZnO). В природе ZnS встречается в двух модификациях:
1. Обычная цинковая обманка, или сфалерит (рис. 1.20), имеет в основе кубическую упаковку анионов цинка Zn, одна половина тетраэдрических пустот которой занята катионами серы S. Структуру сфалерита можно описать как две ГЦК-решетки − серы и цинка, смещенные друг относительно друга на четверть пространственной диагонали куба.
|
|
|
|
Рис. 1.20.
Структура сфалерита |
Рис. 1.21.
Структура вюрцита |
2. Гексагональная модификация - вюрцит (рис. 1.21) - имеет в основе плотнейшую гексагональную упаковку анионов серы, а катионы цинка занимают половину тетраэдрических пустот.
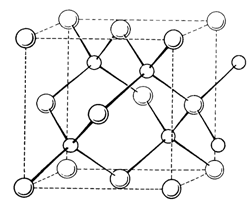
Структура цинковой обманки идентична структуре алмаза, если в ней атомы цинка и серы заменить атомами углерода. К структурному типу алмаза относятся, например, арсенид галлия (GaAs) (рис. 1.22), кремний (Si), германий (Ge).
|
|
Рис.
1.22. Структура арсенида галлия GaAs [2]
|
Перечисленными структурными типами, конечно, не исчерпывается все их многообразие. Более полно с этим вопросом читатель может ознакомиться в учебниках по кристаллографии.