1.7. Полиморфизм
Способность некоторых веществ существовать в нескольких кристаллических фазах, отличающихся друг от друга по симметрии структуры и по свойствам, называется полиморфизмом. Каждая из таких фаз - полиморфная модификация - стабильна в определенной области температур и давлений, за пределами которых наблюдается фазовый переход - процесс превращения одной модификации в другую. Скорость протекания фазового перехода определяется целым рядом факторов: температурой, давлением и т. д.
Наибольшее число полиморфных модификаций образуют из простых веществ − углерод, из сложных − оксид кремния
Некоторые полиморфные модификации углерода [83].
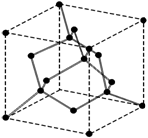
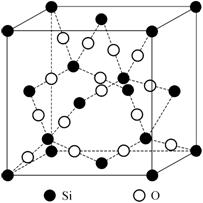
Алмаз (рис. 1.23) имеет неплотно упакованную структуру, где каждый
атом углерода окружен четырьмя такими же атомами, располагающимися по вершинам
тетраэдра, поэтому координационное число ![]() . Атомы углерода занимают все узлы ГЦК-ячейки, а также центры
половины октантов, на которые можно разбить куб, причем заполненные и
незаполненные октанты чередуются в шахматном порядке: рядом с заполненным
октантом − незаполненный, под незаполненным − заполненный. В
структурном типе алмаза тенденция атомов углерода образовывать направленные
связи столь высока, что алмазная структура оказывается более энергетически
выгодной, нежели плотно упакованная.
. Атомы углерода занимают все узлы ГЦК-ячейки, а также центры
половины октантов, на которые можно разбить куб, причем заполненные и
незаполненные октанты чередуются в шахматном порядке: рядом с заполненным
октантом − незаполненный, под незаполненным − заполненный. В
структурном типе алмаза тенденция атомов углерода образовывать направленные
связи столь высока, что алмазная структура оказывается более энергетически
выгодной, нежели плотно упакованная.
|
|
|
Рис. 1.23. Структура алмаза (кружками обозначены атомы углерода) |
Графит
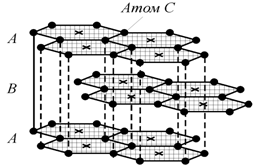
(рис. 1.24) существует в двух модификациях − гексагональной и
ромбоэдрической. Гексагональная модификация термодинамически устойчива при
температурах ниже ![]() . Структура графита слоистая, причем каждый их чередующихся
слоев построен по одному и тому же закону из гексагональных ячеек. Каждый слой
смещен по отношению к двум другим соседним слоям на половину большой диагонали
гексагона. Поэтому структура двухслойная с чередованием слоев АВАВАВ… В элементарной ячейке содержится
4 атома. Кратчайшее межатомное расстояние в слое 1,42 Å и на этом
расстоянии каждый атом углерода соседствует с тремя другими. Кратчайшее
расстояние между слоями 3,347 Å и у некоторых атомов на этом расстоянии
находится 2 соседа, а у других имеется 12 соседей на расстоянии 4,151 Å.
Структура графита является примеров слоистой структуры: периоды решетки по оси с и по осям, лежащим в плоскости слоев,
различаются очень сильно. Внутри слоя действуют прочные ковалентные связи,
между слоями − слабые ван-дер-ваальсовы связи. В кристаллах со слоистой
структурой очень сильно различие физических свойств вдоль и поперек плоскостей
слоев. Так, в графите электропроводность вдоль слоев в 105 раз
больше, чем в поперечном направлении. Вследствие слоистости структуры кристаллы
графита легко деформируются смещением одного слоя относительно другого, что
позволяет применять графит в качестве смазки, грифелей карандашей и др.
. Структура графита слоистая, причем каждый их чередующихся
слоев построен по одному и тому же закону из гексагональных ячеек. Каждый слой
смещен по отношению к двум другим соседним слоям на половину большой диагонали
гексагона. Поэтому структура двухслойная с чередованием слоев АВАВАВ… В элементарной ячейке содержится
4 атома. Кратчайшее межатомное расстояние в слое 1,42 Å и на этом
расстоянии каждый атом углерода соседствует с тремя другими. Кратчайшее
расстояние между слоями 3,347 Å и у некоторых атомов на этом расстоянии
находится 2 соседа, а у других имеется 12 соседей на расстоянии 4,151 Å.
Структура графита является примеров слоистой структуры: периоды решетки по оси с и по осям, лежащим в плоскости слоев,
различаются очень сильно. Внутри слоя действуют прочные ковалентные связи,
между слоями − слабые ван-дер-ваальсовы связи. В кристаллах со слоистой
структурой очень сильно различие физических свойств вдоль и поперек плоскостей
слоев. Так, в графите электропроводность вдоль слоев в 105 раз
больше, чем в поперечном направлении. Вследствие слоистости структуры кристаллы
графита легко деформируются смещением одного слоя относительно другого, что
позволяет применять графит в качестве смазки, грифелей карандашей и др.
|
|
|
Рис. 1.24. Кристаллическая решетка графита [52] |
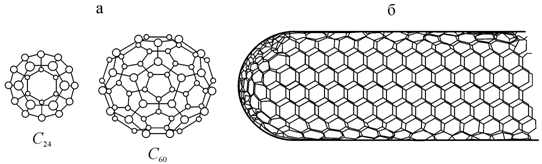
Способность атомов углерода образовывать структуры в виде сеток ярко проявляется в таких интересных объектах, как фуллерены. Как уже было сказано выше, фуллерены представляют собой семейство шарообразных молекул, содержащих различное число атомов углерода. Их поверхность состоит из соприкасающихся шестиугольников (гексаэдров) и пятиугольников (пентагонов), в вершинах которых располагаются атомы углерода (1.25, а).
Наиболее изучены структура,
свойства и технология получения фуллерена ![]() , который состоит из 20 гексаэдров и 12 пентагонов [28, 98].
Атомы углерода в вершинах многоугольников соединены ковалентными связями,
причем каждый атом в молекуле связан с тремя соседними атомами одной короткой
(1,39 Å) и двумя длинными (1,493 Å) связями.
, который состоит из 20 гексаэдров и 12 пентагонов [28, 98].
Атомы углерода в вершинах многоугольников соединены ковалентными связями,
причем каждый атом в молекуле связан с тремя соседними атомами одной короткой
(1,39 Å) и двумя длинными (1,493 Å) связями.
Центр молекулы фуллерена представляет собой свободную сферу (пору), в которой могут размещаться атомы других элементов. Они играют роль легирующих примесей. В фуллеренах больших размеров могут размещаться, в частности, даже молекулы других фуллеренов меньших размеров. Кроме того, атомы примесей могут замещать атомы углерода на поверхности молекул.
|
|
|
Рис. 1.25. Кристаллческие модификации углерода: а − молекулы фуллерена |
Практический интерес представляют
фуллерены в кристаллическом состоянии, которые представляют собой еще одну
полиморфную модификацию углерода. В этом случае они носят название фуллериты. Например, фуллерит ![]() при температуре 300 К
обладает гранецентрированной кубической решеткой, в узлах которой размещены
молекулы фуллерена. Между этими молекулами в решетке действуют слабые
ван-дер-ваальсовы связи. С понижением температуры до 255 К происходит
превращение ГЦК решетки в простую кубическую. Фуллерит
при температуре 300 К
обладает гранецентрированной кубической решеткой, в узлах которой размещены
молекулы фуллерена. Между этими молекулами в решетке действуют слабые
ван-дер-ваальсовы связи. С понижением температуры до 255 К происходит
превращение ГЦК решетки в простую кубическую. Фуллерит ![]() проявляет
полупроводниковые свойства, причем атомы примеси могут играть в нем роль
доноров или акцепторов.
проявляет
полупроводниковые свойства, причем атомы примеси могут играть в нем роль
доноров или акцепторов.
Важнейшее значение в настоящее время приобретают наноразмерные углеродные трубки (сокращенно − нанотрубки). По механизму своего образования они близки к фуллеренам. В простейшем случае нанотрубку можно представить как свернутый в цилиндр лист графита толщиной в один атомный слой (рис. 1.25, б). В отличие от фуллерена, атомы углерода в нанотрубке расположены только в виде соприкасающихся шестиугольников. На концах нанотрубок образуются «шапочки» конической или сферической формы. Нанотрубки могут быть как однослойными, так и многослойными, иметь различный диаметр и отличаться размещением шестиугольников по длине трубки. Многослойные трубки обычно имеют внешний диаметр 40−50 Å и состоят из вставленных одна в другую трубок все меньшего диаметра.
Области эффективного применения фуллеритов и нанотрубок находятся сейчас в стадии активного изучения. Имеются прогнозы, по которым эти материалы будут иметь большое значение в области электроники, машино- и приборостроения, медицины и в других областях. Особое значение здесь может иметь использование фуллеренов для повышения быстродействия электронных приборов, предназначенных для работы в условиях высоких температур, а также для существенного повышения теплопроводности, которое необходимо для дальнейшей миниатюризации элементов интегральных схем. Широкое использование в медицине связано с хорошей совместимостью фуллеренов с тканями человеческого организма. Нанотрубки обладают хорошими механическими свойствами и перспективны для создания материалов, обладающих высокой прочностью.
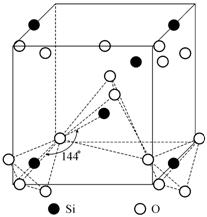
Полиморфные модификации диоксида кремния (SiO2) [75, 24].
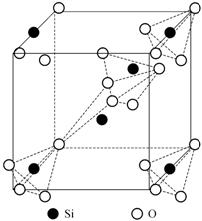
Низкотемпературная модификация
окисла кремния a-кварц при температуре
![]() переходит в b-кварц.
В обеих модификациях координационный многогранник - тетраэдр, в углах
которого находятся атомы кислорода, а в центре - атом кремния. Соседние
тетраэдры связаны между собой вершинами. На рис. 1.26 показана элементарная
ячейка a-кварца
и цепочка координационных многогранников в ней.
переходит в b-кварц.
В обеих модификациях координационный многогранник - тетраэдр, в углах
которого находятся атомы кислорода, а в центре - атом кремния. Соседние
тетраэдры связаны между собой вершинами. На рис. 1.26 показана элементарная
ячейка a-кварца
и цепочка координационных многогранников в ней.
|
|
|
Рис. 1.26. Элементарная ячейка a-кварца и координационные многогранники SiO4 |
При переходе от a- к b-кварцу атомы кремния сохраняют свои положения в слоях по оси Z, а по направлению осей X и Y смещаются к центрам элементарных трансляций на небольшие величины. Эти фазы имеют родственные пространственные группы, но симметрия в b-кварце выше. В процессе этого полиморфного превращения происходит только снятие искажений и поворот тетраэдров (рис. 1.27), а связи Si-O не разрушаются.
|
|
|
Рис. 1.27. Элементарная ячейка b-кварца и цепь координационных многогранников в ней |
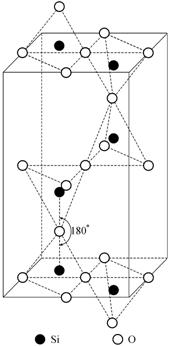
При температуре ![]() b-кварц
переходит в следующую полиморфную модификацию SiO2 - b-тридимит
(рис. 1.28). Координационный многогранник и характер структуры сохраняются. Как
и в первых двух модификациях, тетраэдры здесь образуют шестичленные кольца, но
период ячейки возрастает примерно в полтора раза. Угол связи между тетраэдрами
увеличивается до
b-кварц
переходит в следующую полиморфную модификацию SiO2 - b-тридимит
(рис. 1.28). Координационный многогранник и характер структуры сохраняются. Как
и в первых двух модификациях, тетраэдры здесь образуют шестичленные кольца, но
период ячейки возрастает примерно в полтора раза. Угол связи между тетраэдрами
увеличивается до ![]() , причем связь является зеркально симметричной.
, причем связь является зеркально симметричной.
|
|
|
Рис. 1.28. Элементарная ячейка b-тридимита |
Если в a- и b-кварце атомы кислорода в тетраэдрах, образующих при взгляде на структуру сверху шестичленные кольца, не лежат в одной плоскости, то в b-тридимите одна из граней каждого из этих тетраэдров находится в плоскости, перпендикулярной оси Z. При переходе к этой полиморфной модификации оксида кремния фазовое превращение протекает с разрывом связей Si-O и образованием новых связей.
При температуре ![]() происходит полиморфное
превращение b-тридимита
в b-кристобалит. В этой
высокосимметричной модификации двуокиси кремния атомы кремния образуют решетку
типа алмаза (рис. 1.29).
происходит полиморфное
превращение b-тридимита
в b-кристобалит. В этой
высокосимметричной модификации двуокиси кремния атомы кремния образуют решетку
типа алмаза (рис. 1.29).
|
|
|
Рис. 1.29. Элементарная ячейка b-кристобалита |
Так же, как в кварце и тридимите,
первый координационный многогранник b-кристобалита
представляет собой тетраэдр из атомов кислорода, в центре которого находится
атом кремния, а всю структуру можно представить в виде связанных углами
тетраэдров. Угол связи между тетраэдрами составляет ![]() , и атом кислорода находится в центре инверсии.
, и атом кислорода находится в центре инверсии.
Кроме перечисленных существуют и другие кристаллические модификации диоксида кремния. Например: тетрагональная модификация SiO2 − стишовит, полученный в лабораторных условиях при 1200−1400° С и давлении порядка 1,6×108 Па, моноклинная модификация SiO2 − коэсит, также получаемый при большом давлении.
Аморфный диоксид кремния считается еще одной из полиморфных модификаций SiO2, достаточно стабильной и в массивном, и в пленочном состоянии. Однако, как показали экспериментальные исследования, аморфный - не означает одинаковый по атомному распределению: ближний порядок в нем зависит от способа получения.