2.3.2. Ковалентная связь
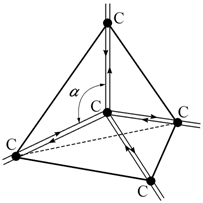
Ковалентная связь характеризуется высокой электронной плотностью в области между ионами, а также явно выраженным свойством направленности. К кристаллам с преимущественно ковалентной связью относятся алмаз (C), кремний (Si), германий (Ge), теллур (Te), т. е. вещества, атомы которых по своему положению в периодической системе не расположены близко к инертным газам. В структуре алмаза атомы углерода соединяются друг с другом так, что четыре их связи располагаются в пространстве симметрично. Каждый атом углерода помещается в центре тетраэдра, образованного атомами, являющимися его ближайшими соседями (рис. 2.5).
|
|
|
Рис. 2.5. Расположение атомов углерода в структуре алмаза. Стрелки − направления обмена электронами |
Ковалентная связь обычно образуется двумя электронами, по одному от каждого из соединяющихся атомов. Спины этих электронов антипараллельны (↑↓).
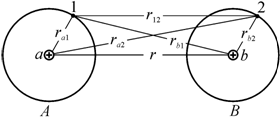
Рассмотрим механизм образования ковалентной связи на примере связи в молекуле водорода H2. Пусть два атома водорода А и В (рис. 2.6) находятся на сравнительно большом расстоянии r друг от друга. Атом А, состоящий из ядра а и электрона 1, и атом В, состоящий из ядра b и электрона 2. Вследствие того, что плотность электронного облака очень быстро падает с расстоянием, обнаружить электрон 1 у ядра b и электрон 2 у ядра а весьма маловероятно.
|
Рис. 2.6. К рассмотрению образования молекулы водорода |
Было
показано, что при ![]() частота перехода будет
составлять приблизительно один раз в
частота перехода будет
составлять приблизительно один раз в ![]() лет. Поэтому атомы A и B
можно рассматривать как изолированные и энергию системы, состоящей из таких
атомов, принимать равной
лет. Поэтому атомы A и B
можно рассматривать как изолированные и энергию системы, состоящей из таких
атомов, принимать равной ![]() , где
, где ![]() – энергия
изолированного атома в нормальном состоянии. При сближении атомов вероятность
перехода электрона возрастает, и при
– энергия
изолированного атома в нормальном состоянии. При сближении атомов вероятность
перехода электрона возрастает, и при ![]() частота перехода
увеличивается примерно до
частота перехода
увеличивается примерно до ![]() . При дальнейшем сближении степень перекрытия электронных
облаков атомов возрастает настолько, что нет смысла говорить о принадлежности
электронов какому-либо определенному атому, т. е. электроны обобществлены. Это
ведет к перераспределению плотности вероятности нахождения электрона на
расстоянии r от одного или другого ядра
. При дальнейшем сближении степень перекрытия электронных
облаков атомов возрастает настолько, что нет смысла говорить о принадлежности
электронов какому-либо определенному атому, т. е. электроны обобществлены. Это
ведет к перераспределению плотности вероятности нахождения электрона на
расстоянии r от одного или другого ядра ![]() и изменению энергии
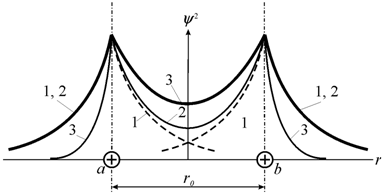
системы по сравнению с энергией изолированных атомов. На рис. 2.7 пунктирными
линиями (1) показана плотность вероятности для
изолированных атомов, тонкой сплошной линией (2) − суммарная
плотность, которая получилась бы при простом наложении электронных облаков
изолированных атомов, и жирной линией (3) − распределение плотности вдоль
оси, соединяющей ядра a и b, фактически устанавливающееся при
обобществлении электронов. Видно, что при обобществлении электронов происходит
втягивание электронных облаков в пространство между ядрами.
и изменению энергии
системы по сравнению с энергией изолированных атомов. На рис. 2.7 пунктирными
линиями (1) показана плотность вероятности для
изолированных атомов, тонкой сплошной линией (2) − суммарная
плотность, которая получилась бы при простом наложении электронных облаков
изолированных атомов, и жирной линией (3) − распределение плотности вдоль
оси, соединяющей ядра a и b, фактически устанавливающееся при
обобществлении электронов. Видно, что при обобществлении электронов происходит
втягивание электронных облаков в пространство между ядрами.
|
|
Рис. 2.7. Вид распределения плотности вероятности нахождения электронов в молекуле водорода [59] |
Появление состояния с повышенной плотностью вероятности нахождения электронов в пространстве между ядрами вызывает уменьшение энергии системы и приводит к возникновению сил притяжения между атомами.
Количественный расчет для молекулы водорода был проведен Гейтлером и Лондоном. Он показал, что система из двух атомов водорода, в зависимости от направления спина в них, может обладать двумя значениями энергии:
|
|
(2.26) |
при антипараллельном направлении спинов и
|
|
(2.27) |
при их
параллельной ориентации. Здесь K
− суммарная энергия электростатического взаимодействия электронов с
ядрами, электронов между собой и ядер между собой. Ее называют также
кулоновской энергией, и по знаку она отрицательна. А представляет собой энергию обменного взаимодействия, которая
появляется вследствие перераспределения электронной плотности при образовании
из атомов молекулы. По знаку она также отрицательна и по абсолютной величине
значительно превосходит кулоновскую. S
− интеграл неортогональности, величина которого заключена в пределах ![]() . Состояние с энергией
. Состояние с энергией ![]() называется
симметричным, а с
называется
симметричным, а с ![]() −
антисимметричным.
−
антисимметричным.
Поскольку К и А
отрицательны, а ![]() , при образовании антисимметричного состояния
энергия системы увеличивается. Это соответствует возникновению сил
отталкивания, и молекула не образуется.
, при образовании антисимметричного состояния
энергия системы увеличивается. Это соответствует возникновению сил
отталкивания, и молекула не образуется.
Основной характерной особенностью ковалентных кристаллов является то, что количество ковалентных связей, образуемых каждым атомом со своими соседями, равно количеству неспаренных внешних электронов атома в свободном состоянии или в возбужденном валентном состоянии.
Кроме того, важными особенностями ковалентной связи являются насыщенность и направленность. Насыщенность выражает тот факт, что каждый атом способен образовывать ковалентную связь с определенным числом своих соседей. Так, каждый атом водорода может устанавливать связь лишь с одним своим соседом. Направленность ковалентной связи выражается в том, что связь образуется в тех направлениях, в которых локализуется электронная плотность, т. е. максимально перекрываются электронные облака. Вследствие направленности связей ковалентные кристаллы обладают высокой твердостью и хрупкостью.
В молекуле Н2
энергия химических связей зависит только от расстояния между атомами. Но силы,
действующие между атомами, не всегда центральны. Например, в алмазе атомы
углерода находятся в тетраэдрическом окружении, и для расчета энергии надо
знать не только расстояние между атомами, но и значения валентных углов (на
рис. 2.5 ![]() ).
).
В реальных веществах ковалентные
связи в чистом виде редко реализуются и имеют в какой-то мере частично ионный
характер. Соединений, близких к идеально ионным, также чрезвычайно мало. Долю
ионности связи можно оценить, исходя из электроотрицательностей ![]() и
и ![]() взаимодействующих
атомов А и В. Относительная ионность равна
взаимодействующих
атомов А и В. Относительная ионность равна ![]() . Если ионность равна 1, т. е. составляет 100 %, то связь
между атомами чисто ионная; если она равна 0, то связь чисто ковалентная. В
табл. 2.4 [63, 102] приведены
приблизительные значения ионности связи в процентах для некоторых соединений.
. Если ионность равна 1, т. е. составляет 100 %, то связь
между атомами чисто ионная; если она равна 0, то связь чисто ковалентная. В
табл. 2.4 [63, 102] приведены
приблизительные значения ионности связи в процентах для некоторых соединений.
Таблица 2.4
Доля ионной связи в межатомном
взаимодействии для некоторых соединений
|
Соединение |
Доля ионной связи, % |
|
RbF |
96 |
|
NaCl
|
94 |
|
CaF2 |
89 |
|
MgO |
84 |
|
ZnO |
62 |
|
ZnS |
62 |
|
SiO2 |
51 |
|
GaAs |
32 |
|
GaSb |
26 |
|
SiC |
18 |
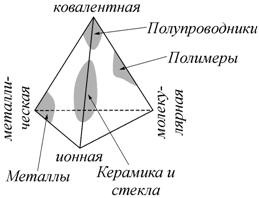
Существует достаточно много схем классификации материалов, основывающихся на их различных физических свойствах. Например, по магнитным свойствам все вещества относят к трем основным типам магнетиков: диа-, пара- и ферромагнетикам. Другая классификация основывается на электрических свойствах веществ и подразделяет их на проводники, диэлектрики и полупроводники. Часто используемая в современной научной литературе схема деления материалов на классы базируется на их принадлежности к металлам, керамикам и стеклам, полупроводникам и полимерам. На рис. 2.8 схематически показано, какие виды межатомной связи ответственны за образование каждой их этих четырех категорий материалов.
|
|
|
Рис. 2.8. Тетраэдр, представляющий относительное распределение различных типов связи в четырех основных категориях материалов [98] |