13.1.1. Условия фазового равновесия
В наиболее общей форме условия фазового равновесия можно получить, исходя из первого и второго начал термодинамики. Второе начало термодинамики в формулировке Клаузиуса дает ключ для получения условий равновесия: при равновесии энтропия изолированной системы максимальна. Это означает, что все самопроизвольные процессы, протекающие в изолированной системе, сопровождаются увеличением энтропии. Например, диффузия атомов и химические реакции ведут к увеличению энтропии.
Рассмотрим вопрос о том, какое из возможных состояний системы отвечает термодинамическому равновесию, т. е. при отсутствии внешнего воздействия может существовать неограниченно долго. Для равновесия недостаточно, чтобы какой-либо термодинамический потенциал имел экстремальное значение. Принцип экстремальности применим только в том случае, когда сравниваемые состояния удовлетворяют определенным условиям: например, рассматриваются состояния изолированной системы или состояния с постоянной температурой и давлением.
В изолированной системе при равновесии экстремального значения достигает энтропия. Однако гораздо чаще процессы протекают не в изолированной системе, а при постоянной температуре. Рассмотрим условие изотермического равновесия. Для таких систем справедливо основное неравенство термодинамики для неравновесных процессов
|
|
(13.8) |
Если рассматривать изотермические процессы, протекающие при постоянном объеме, и перейти к независимым переменным, объему и температуре (V и T), то уравнение (13.8) примет вид
|
|
(13.9) |
Следовательно,
в рассматриваемой системе с неизменным количеством вещества могут протекать
лишь такие процессы, при которых свободная энергия Гельмгольца не растет. Они
прекращаются, как только свободная энергия F достигает минимума, что
соответствует термодинамическому равновесию системы. Таким образом, при
постоянных температуре (T) и объеме (V) состоянию
равновесия отвечает минимум свободной энергии Гельмгольца ![]() . Аналогично для энергии Гиббса (от p и T)
. Аналогично для энергии Гиббса (от p и T)
|
|
(13.10) |
В этом случае равновесному
состоянию системы отвечает минимум термодинамического потенциала Гиббса ![]() .
.
Найденные условия термодинамического равновесия позволяют выделить равновесное состояние среди других, но они ничего не говорят о возможных внутренних условиях, определяющих равновесие между компонентами системы.
Исследуем условия равновесия фаз, имеющих в общем случае различный химический состав. Зафиксируем опять температуру (T) и давление (p). Тогда для системы из двух фаз α и β должно выполняться требование минимума термодинамического потенциала. В состоянии равновесия имеем
|
|
(13.11) |
Поскольку
температура, давление и общее количество вещества неизменны, то изменения
возможны только в отношении состава фаз, т. е. какое-то количество компонента K может перейти из одной фазы в другую. При этом число молей
компонента K в фазах α и β: ![]() ,
, ![]() изменяется на величины
изменяется на величины
![]() и
и ![]() . Тогда
. Тогда ![]() . В результате
. В результате
|
|
(13.12) |
Это условие должно выполняться
для любого изменения количества вещества ![]() , для каждого компонента K, т. е.
, для каждого компонента K, т. е.
|
|
(13.13) |
Итак, при равновесии двух фаз химические потенциалы имеют одинаковую величину для каждого из компонентов, входящих в состав обеих фаз.
Рассмотрим равновесное состояние в многокомпонентной многофазной системе. Пусть фазы α и β находятся в равновесии друг с другом. В зависимости от природы межфазной границы возможны различные виды взаимодействия.
Механическое взаимодействие. Условием
равновесия в этом случае служит равенство давлений в фазах (![]() ). Если поверхность не плоская, то давления могут отличаться
за счет сил поверхностного натяжения.
). Если поверхность не плоская, то давления могут отличаться
за счет сил поверхностного натяжения.
Тепловое взаимодействие. Условием
равновесия при тепловом взаимодействии является равенство температур фаз (![]() ).
).
Материальное взаимодействие. Этот вид
взаимодействия обусловлен обменом частицами между фазами. В этом случае
термодинамическое равновесие определяется равенством химических потенциалов фаз
α и β (![]() ).
).
Таким образом, если система, состоящая из r фаз и n компонентов, находится в физико-химическом взаимодействии, то в равновесном состоянии для каждой из r фаз выполняются условия равенства давлений, температур и химических потенциалов:
|
|
(13.14) |
В общем случае число уравнений в системе (13.14) меньше числа переменных, так что некоторые из переменных и в случае равновесия могут изменяться произвольно. Число таких переменных называется числом степеней свободы системы.
Подсчитаем
число степеней свободы f равновесного состояния системы,
состоящей из n компонентов, в различных фазах,
число которых r. Для полного описания системы
необходимо задать концентрации компонентов в r-фазах,
температуру и давление. Для каждой K-й фазы получаем ![]() независимых
концентраций, а для всех r-фаз число независимых
концентраций будет
независимых
концентраций, а для всех r-фаз число независимых
концентраций будет ![]() . Задавая, кроме того, давление p и
температуру T, получим полное число переменных
. Задавая, кроме того, давление p и
температуру T, получим полное число переменных ![]() . Из этого числа нужно вычесть число уравнений связи (13.14).
Каждая строка системы уравнений (13.14) содержит
. Из этого числа нужно вычесть число уравнений связи (13.14).
Каждая строка системы уравнений (13.14) содержит ![]() независимых уравнений,
а вся система уравнений − соответственно
независимых уравнений,
а вся система уравнений − соответственно ![]() независимых уравнений. В результате получим соотношение
независимых уравнений. В результате получим соотношение
|
|
(13.15) |
где f − число степеней свободы. Т. е. количество степеней свободы термодинамической системы равно разности числа компонентов этой системы и числа фаз плюс две степени свободы за счет температуры и давления. Уравнение (13.15) носит название правило фаз Гиббса.
Поскольку
число степеней свободы ![]() , то
, то ![]() . Таким образом, в системе, находящейся в равновесии, число
фаз не может превышать
. Таким образом, в системе, находящейся в равновесии, число
фаз не может превышать ![]() , где n – число компонентов системы.
, где n – число компонентов системы.
В случае
однокомпонентной системы она может содержать одну, две или три фазы. Например,
это могут быть жидкая, твердая и газообразная фазы. При трехфазном равновесии число
степеней свободы ![]() , т. е. такое равновесие возможно только при определенных
значениях давления (p) и температуры (T).
, т. е. такое равновесие возможно только при определенных
значениях давления (p) и температуры (T).
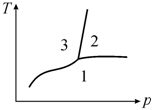
На фазовой диаграмме состояние трехфазного равновесия изображается тройной точкой (рис. 13.2).
|
|
|
Рис. 13.2. Кривые фазового равновесия в однокомпонентной системе (точка пересечения кривых − тройная точка) |
При двухфазном
равновесии имеется одна термодинамическая степень свободы ![]() . Это означает, что одна из величин p или T может меняться произвольно, а
другая будет определяться уравнением
. Это означает, что одна из величин p или T может меняться произвольно, а
другая будет определяться уравнением
|
|
(13.16) |
где ![]() и
и ![]() –
химические потенциалы рассматриваемых фаз. Связь между давлением и температурой
в графическом представлении - это линии двухфазного равновесия, изображенные на рис.
13.2 в виде трех соединяющихся в одной точке линий.
–
химические потенциалы рассматриваемых фаз. Связь между давлением и температурой
в графическом представлении - это линии двухфазного равновесия, изображенные на рис.
13.2 в виде трех соединяющихся в одной точке линий.
Для
однофазного равновесия ![]() и значения давления p и
температуры T могут меняться в пределах определенных
областей (на рис. 13.2 − области 1, 2, 3), в каждой из которых существует
соответственно твердая, жидкая и газообразная фазы.
и значения давления p и
температуры T могут меняться в пределах определенных
областей (на рис. 13.2 − области 1, 2, 3), в каждой из которых существует
соответственно твердая, жидкая и газообразная фазы.
В случае равновесия в системах, представляющих собой металлические сплавы, можно ограничиться конденсированными состояниями (т. е. твердым и жидким). Тогда число степеней свободы уменьшается на единицу
|
|
(13.17) |
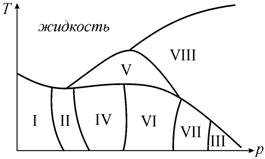
Этот подход правомерен, если давлением можно пренебречь (например, в случае, когда давление паров металлов мало). Однако некоторые системы очень чувствительны к изменению давления. Например, для висмута давление оказывает такую роль, что на фазовой диаграмме имеется целых 8 областей, соответствующих различным кристаллическим модификациям (рис. 13.3).
|
|
|
Рис. 13.3. Схематическая (p−T)-диаграмма состояний висмута [55] |
Условия
фазового равновесия, как показано на рис. 13.3, можно описывать не только
аналитически, но и графически. Для графического описания используют диаграммы
фазовых равновесий, или фазовые диаграммы. Фазовая диаграмма
многокомпонентной системы (![]() ) − геометрическое изображение фазовых состояний
(равновесий и превращения фаз), которые реализуются при тех или иных параметрах
в результате взаимодействия компонентов, входящих в систему.
) − геометрическое изображение фазовых состояний
(равновесий и превращения фаз), которые реализуются при тех или иных параметрах
в результате взаимодействия компонентов, входящих в систему.
Диаграммы фазового равновесия многокомпонентных систем строят в координатах p − T − X ), где X − концентрация компонентов, а однокомпонентных систем − в координатах p − T. Каждая точка диаграммы фазового равновесия характеризует параметры физико-химических систем, образующихся в результате взаимодействия компонентов, для которых построена диаграмма фазового равновесия.
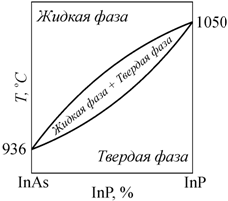
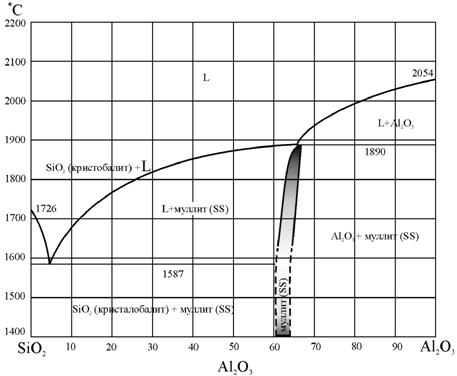
Диаграммы фазового равновесия в координатах концентрация−температура (диаграммы T−X) для двухкомпонентных систем изображаются на плоскости. Простейший пример такой диаграммы для полупроводникового соединения, где компонентами являются индий, мышьяк и фосфор (InAs − InP), показан на рис. 13.4. Такой вид фазовой диаграммы характерен для твердых растворов с неограниченной растворимостью. Более сложный вид имеют фазовые диаграммы в системах с ограниченной растворимостью. Подобная диаграмма для системы Al2O3 - SiO2 приведена на рис. 13.5.
|
|
|
Рис. 13.4. Диаграмма фазового равновесия InAs − InP |
|
|
|
Рис.13.5. Фазовая диаграмма Al2O3 -SiO2 [98]
(латинскими буквами указаны области на фазовой диаграмме, где присутствует
жидкая -
L и твердая - SS фазы) |
Для трехкомпонентных систем диаграммы строят в трехмерном пространстве, а диаграммы с числом компонентов, большим трех, требуют специальных сложных приемов построения. Если параметром является также давление, то для двухкомпонентных систем диаграммы являются трехмерными.
С помощью диаграммы фазового равновесия для данных условий можно определить следующее: 1) число фаз в системе; 2) относительное количество каждой из фаз; 3) состав каждой фазы и ее природу (чистый компонент, раствор, соединение); 4) характер фазовых превращений.
Надо иметь в виду, что диаграмма фазового равновесия не дает информации об атомном строении фаз и их кристаллической решетке. Это самостоятельный вопрос, знание которого важно для характеристики системы и понимания свойств фаз. Диаграмма может считаться полностью достоверной, если с помощью рентгеноструктурного анализа или иных методов расшифровано атомное строение каждой из твердых фаз данной системы.
Главными методами построения диаграмм сейчас являются методы физико-химического анализа, основы которого были разработаны академиком Н. С. Курнаковым и его школой. Физико-химический анализ базируется на изучении функциональной зависимости между значениями физических свойств и параметрами концентрации, температуры и давления (X, T, p). Знание этих зависимостей позволяет устанавливать физико-химическую природу фаз и границы их существования.
Для построения
диаграмм фазового равновесия используют различные экспериментальные методы,
такие как термографический, микрорентгеноспектральный, рентгеноструктурный,
дилатометрический и другие методы анализа.
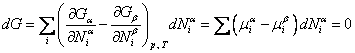 .
.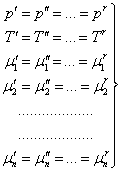 .
.