К конденсированному состоянию относятся два агрегатных состояния вещества: жидкое и твердое. Конденсированные материалы представляют собой ансамбли сильно взаимодействующих частиц (атомов, ионов, молекул, электронов), в которых расстояния между частицами устанавливаются так, чтобы силы притяжения и отталкивания были уравновешены. Именно поэтому конденсированные системы оказывают сильное сопротивление изменению объема. Те же из них, которые, наряду с этим, оказывают сильное сопротивление изменению формы, называются твердыми телами.
На границе между твердыми телами и жидкостями находятся аморфные материалы. Аморфные материалы также оказывают большое сопротивление изменению объема, но не могут сохранять форму бесконечно долго. Последнее время их относят к твердым телам. Твердые тела можно классифицировать по характеру взаимного расположения атомов следующим образом.
1. Идеальные монокристаллы. К ним относятся твердые тела, в которых реализуется идеальная трансляционная симметрия в расположении атомов, то есть реализуется идеальный дальний порядок. Это означает, что атомы расположены регулярно и по сортам, и по расстояниям.
Рассмотрим кристалл каменной соли NaCl, элементарная ячейка которого представлена на рис. 1.
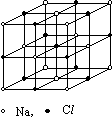
Вдоль осей XYZ атомы натрия Na и хлора Cl чередуются.
Такой мотив расположения атомов в пространстве продолжается до бесконечности и получается трансляцией (смещением) базисной группы атомов на вектор,
соединяющий в любом направлении два атома одного и того же сорта.
Вектор, смещение на который позволяет совместить систему атомов саму с собой, называется вектором трансляции.
Элементарными трансляциями называется кратчайшая для данного материала тройка некомпланарных векторов трансляции.
На этих векторах строится параллелепипед, называемый элементарной ячейкой кристалла.
Трансляция такой ячейки во всех направлениях полностью воспроизводит пространственную решетку кристалла.
Элементарная ячейка характеризуется периодами (элементарные трансляции) ![]() и углами α, β, γ.
В веществах с дальним порядком все характеристики инвариантны относительно смещения тела на величину вектора трансляции
и углами α, β, γ.
В веществах с дальним порядком все характеристики инвариантны относительно смещения тела на величину вектора трансляции
![]()
![]() ,
где m , n , p - целые числа [1].
,
где m , n , p - целые числа [1].
Структурный тип.
Структура кристалла-это конкретное расположение частиц в пространстве. Описывая структуру, надо указывать вид и размер частиц и расстояние между ними. Но так как многие структуры сходны, можно иногда указывать лишь относительное расположение частиц(атомов или атомных групп) в кристалле, а не абсолютные расстояния между ними. Так определяется структурный тип. Структуры кристаллов, принадлежащих к одному структурному типу, одинаковы с точностью до подобия [2].
Полиморфизм кристаллов.
Полиморфизм кристаллов-способность некоторых минералов и иных кристаллических веществ существовать при одном и том же химическом составе в состояниях с различной атомной кристаллической структурой. Каждое из таких состояний (термодинамических фаз), называется полиморфной модификацией, устойчивой при определённых внешних условиях (температуре и давлении). Модификации обозначаются обычно греческими буквами a, b, g и т.д. Различие в структуре обусловливает и различие в свойствах полиморфных модификаций данного вещества. Полиморфизм был открыт в 1798г., когда было обнаружено, что СаСО3 может существовать в виде 2 минералов, кристаллизующихся в различных сингониях - кальцита и арагонита. Полиморфизмом обладают простые вещества (Аллотропия), а также неорганические и органические соединения. Так, углерод имеет 2 модификации: кубическую (алмаз) и гексагональную (графит), резко различающиеся по физическим свойствам. Белое олово, имеющее тетрагональную объёмноцентрированную решётку - пластичный металл, а серое олово (низкотемпературная модификация с алмазоподобной тетрагональной решёткой) хрупкий полупроводник. Некоторые соединения, например SiO2, имеют более 2-х полиморфных модификаций. Перестройка кристаллической решётки при полиморфном переходе сводится к сдвигам атомов, изменению типа их упаковки, к поворотам некоторых структурных группировок (например, NH4 и NO3 в разных модификациях NH4NO3). Полиморфизм наблюдается и у жидких кристаллов [3].
Полиморфизм является результатом того, что одни и те же атомы и молекулы могут образовывать в пространстве несколько устойчивых решёток. Т. к. любое малое искажение устойчивой решётки связано с увеличением её энергии, то существующие структурные состояния соответствуют энергетическим минимумам различной глубины. При Т = 0° К, наиболее вероятна a-модификация, которой отвечает глубокий минимум. При Т > 0° К термодинамическое состояние решётки определяется её свободной энергией U = Е - TS, включающей в себя наряду с энергией Е энтропийную часть TS (S - энтропия), связанную с тепловыми колебаниями кристаллической решётки. Имеющая меньшую энергию более прочная (a-решётка менее восприимчива к возбуждению колебаний и характеризуется более пологой зависимостью U (T). Кривые Ua(T) и Ub(T) пересекаются при некоторой температуре T0. Ниже T0 более стабильна a-фаза, выше - b-фаза, T0 - температура равновесия a- и b-фаз. При нагреве a-модификации выше T0 она превращается в b-модификацию. При дальнейшем повышении температуры (b-модификация может стать менее стабильной, чем g-модификация, которая, в свою очередь, затем превращается в d-модификацию до тех пор, пока температура не превысит температуру плавления кристалла [4].
Аллотропия (от греч. allos — другой, греч. tropos — поворот, свойство) — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам, т. е. аллотропических модификаций или аллотропических форм. Примеры аллотропии: 1) О2 - кислород и О3 - озон. Кислород бесцветен, не имеет запаха, озон же пахуч, имеет бледно-фиолетовый цвет, он более бактерициден. 2) Красный фосфор и белый фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор неядовит, не светится в темноте, сам по себе не воспламеняется. Аллотропия может быть результатом образования молекул с различным числом атомов (например, атомарный кислород O, молекулярный кислород O2 и озон O3) или образования различных кристаллических форм (например, графит и алмаз); в этом случае аллотропия — частный случай полиморфизма.
Сам факт перестройки кристаллической структуры при изменении внешних факторов равновесия, как полагает В. М. Гольдшмидт, обусловливается не тем, что при этом меняются межатомные или межионные расстояния, а тем, что происходят сильные изменения во взаимной поляризации структурных единиц, удерживаемых в решетке электростатическими силами. В простейшем случае в момент критического состояния происходит изменение координационного числа, свидетельствующее о коренном изменении строения вещества.
Каждая модификация устойчива в определённой области температуры, давления, а также других внешних условий. Фазовые диаграммы равновесия определяют области устойчивости полиморфных модификаций (Диаграмма состояния). Теоретический расчёт фазовых диаграмм основан на вычислении термодинамических характеристик, а также энергии и спектра колебаний кристаллической решётки для различных полиморфных модификаций. Например, расчёт диаграммы состояния С позволил установить, что область возникновения структуры алмаза лежит при давлениях ~50 кбар, что облегчило путь к синтезу алмазов.
Переход менее стабильной модификации в более стабильную связан с преодолением энергетического барьера, который существенно меньше, если превращение происходит постепенно, путём зарождения и последующего роста в ней областей новой фазы. Барьер преодолевается за счёт тепловых флуктуаций; поэтому, если вероятность флуктуаций мала, менее устойчивая фаза может длительное время существовать в метастабильном состоянии. Например, алмаз, метастабильный при атмосферном давлении и комнатной температуре, может существовать неограниченно долго, не превращаясь в стабильный в этих условиях графит. В других веществах, наоборот, различные модификации легко переходят друг в друга при изменении температуры и др. Поскольку превращение проходит через стадию сосуществования исходной и образующейся фаз, между фазами возникает упругое взаимодействие, влияющее на развитие превращения. Эти взаимодействия особенно проявляются при мартенситных превращениях.
Таким образом, различают два вида полиморфизма. Первый вид, - "энантиотропия" - характеризуется обратимостью переходов полиморфных модификаций из одной в другую при определённых температурах и давлениях. Примером энантиотропии могут служить переходы кварца в высокотемпературную разновидность SiO2 - тридимит, а также переходы алмаза в графит. Второй вид, - "монотропия", - когда одна полиморфная модификация (нестабильная) может переходить в другую (стабильную) , но обратный переход невозможен. Примером монотропии является переход марказита в пирит, а также превращение ромбического арагонита в тригональный кальцит (при нагревании). Наиболее строгая классификация полиморфных переходов основана на степени и характере изменения структуры.
Частный случай полиморфизма, называемый политипия, - наблюдается в некоторых кристаллах со слоистой структурой. Политипные модификации построены из одинаковых слоёв или слоистых "пакетов" атомов и различаются способом и периодичностью наложения таких пакетов. Политипные модификации наблюдаются у глинистых минералов, карбида кремния и другие [5].
2. Монокристаллы с дефектами решетки - реальные монокристаллы. Дефекты решетки представляют собой нарушения дальнего порядка и возникают при росте кристаллов или их фазовых превращениях, под влиянием тепловых, механических, электрических и других воздействий, при введении примесей. Различают точечные (нульмерные), линейные (одномерные), поверхностные (двумерные) и объёмные (трёхмерные) дефекты.
К собственным точечным дефектам относятся вакансии (отсутствие атома в узле решетки) и междоузельные атомы (атом в пространстве между узлами решетки). Примесные точечные дефекты - это одиночные атомы примеси, которые могут как замещать атом основного элемента в узле решетки, так и располагаться в междоузельном пространстве.
Число собственных и примесных точечных дефектов обычно невелико. Однако существует класс материалов, в которых атомы разного сорта образуют единую кристаллическую решетку. Такие материалы называют сплавами, или твердыми растворами.
В твердых растворах говорят о среднем дальнем порядке. Как идеальные монокристаллы, так и монокристаллы с дефектами характеризуются анизотропией свойств.
К линейным дефектам относятся дислокации. Дислокации - это такие нарушения структуры, когда искажение проходит через весь кристалл по линии. Простейший пример - краевая дислокация: отсутствие полуплоскости в кристалле. Линия дислокации проходит через весь кристалл.Скопление дислокаций при точечном дефекте приводит к разбиению кристалла на отдельные куски - зерна.
Плоские дефекты - границы блоков (слабо разориентированных относительно друг друга областей с идеальным порядком), образуются выстраивающимися в стенки дислокациями.
Объемные дефекты представляют собой поры и включения групп атомов иного сорта. К ним относятся: нарушения, связанные с отклонениями от законов стехиометрии; скопления вакансий; скопления примесей на дислокациях и в зонах роста, нерегулярные образования в виде трещин, пустот, включений иной фазы и другие макроскопические дефекты.
Любые дислокации приводят к изменению свойств материала (полезные и вредные дефекты). От дефектов зависят многие важнейшие св-ва кристаллов — механические, оптические, электрические, магнитные и т.д. В совершенной кристаллической решётке невозможно движение атомов и ионов, так как одновременный обмен местами двух или более атомов (их миграция) энергетически мало вероятен. В кристаллах, содержащих дефекты, с миграцией атомов связаны взаимная диффузия твёрдых тел, твердофазные химические реакции и другие явления. Миграцией заряженных частиц обусловлен в основном электрический ток в ионных кристаллах. Специальное введение дефектов или их устранение — важная часть технологии производства важнейших материалов: примесных полупроводников, активированных люминофоров, лазерных и фотохромных кристаллов и стёкол. В технологии создвния ПП материалов и ПП приборов примесные атомы в кристаллы обычно вводят в процессе кристаллизации или рекристаллизации, диффузией примесей в полупроводник, ионным легированием. Соответствующим образом распределённые донорные и акцепторные примеси в ПП позволяют создавать в ПП кристалле активные и пассивные элементы интегральных схем (диоды, транзисторы, резисторы, конденсаторы и др.) и изолирующие слои между ними. В реальных кристаллах кроме дефектов, полученных в результате целенаправленного воздействия на кристалл, существуют нежелательные дефекты, возникшие случайно под действием неконтролируемых факторов. Например, в примесных ПП монокристаллах, используемых для создания ПП приборов, такими нежелательными дефектами являются прежде всего неудаленные из исходного материала вредные примеси, кластеры, а также краевые и винтовые дислокации. Нежелательные дефекты могут быть источниками свободных носителей заряда, центрами рекомбинации и рассеяния носителей. Это приводит к случайным локальным изменениям электро-физических свойств в объёме ПП. Существование неконтролируемых дефектов в ПП кристаллах является серьезным фактором, сдерживающим микроминиатюризацию элементов ИС, уменьшающим выпуск годных изделий. Кол-во вредных гримесей в исходных ПП кристаллах уменьшают глубокой очисткой материалов. Плотность дислокаций и других нежелательных дефектов можно уменьшить совершенствованием методов выращивания и обработки кристаллов: использованием бездефектных затравок, вырвщиванием кристаллов при предельно малых температурных градиентах в условиях, исключающих механические напряжения, и др. Разработана серия различных методов, позволяющих изучать расположение и основные характеристики такин дефектов, как дислокации, дефекты упаковки и даже точечные дефекты. Среди этих методов особо выделяются оптические методы, ионная и электронная микроскопия, метод избирательного травления, рентгено-дифракционные и ядерно-физические методы.
3. Поликристаллы - вещества, состоящие из большого числа различным образом ориентированных сравнительно небольших монокристаллов (зерен), правильных или содержащих дефекты.
В поликристаллах дальний порядок сохраняется лишь в пределах каждого зерна.
4. Двумерные (квазиплоские) системы - пленки или поверхностные слои твердых тел, в которых трансляционная симметрия сохраняется лишь в плоскости.
5. Аморфные материалы - вещества, в которых отсутствует трансляционная симметрия, т. е. нет дальнего порядка. В аморф-ных веществах сохраняется ближний порядок в расположении образующих его частиц в пределах нескольких межатомных расстояний. Это означает, что расстояния между соседними атомами в любой точке объема оказываются примерно одинаковыми, но с возрастанием расстояния от данной точки регулярность в расположении атомов нарушается. Для аморфных материалов характерна изотропия свойств.
6. Жидкие кристаллы (молекулы выстраиваются в определенный порядок, но силы маленькие).
Жидкие кристаллы- это вещества, обладающие одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропия). По структуре ЖК представляют собой жидкости, похожие на желе, состоящие из молекул вытянутой формы, определённым образом упорядоченных во всем объёме этой жидкости. Наиболее характерным свойством ЖК является их способность изменять ориентацию молекул под воздействием электрических полей, что открывает широкие возможности для применения их в промышленности. По типу ЖК обычно разделяют на две большие группы: нематики и смектики. В свою очередь нематики подразделяются на собственно нематические и холестерические жидкие кристаллы [6].

Рис.2 ЖК.

Рис.3 Смектические ЖК.
Классификация жидких кристаллов.
Существует два вида жидких кристаллов: термотропные и лиотропные. Жидкие кристаллы по классификации, предложенной Ж. Фриделем в 1922 г., разделяются на три класса. В первый класс, названный «смектическим», от греческого слова «смегма» — мыло, входят вещества, состоящие из молекул сигарообразной формы. Смектические жидкие кристаллы состоят из параллельных слоев, в которых молекулы в каждом из слоев либо упорядочены в отдельные ряды, либо располагаются достаточно хаотично (рис. 4). Длинная ось всех молекул в каждом слое всегда перпендикулярна плоскости слоя, толщина которого составляет одну молекулу. Эти две конфигурации аналогичны двум полям кукурузы, одно из которых засеяно рядами, а другое - беспорядочно.
Распространенным примером смектического жидкокристаллического вещества является мыльный пузырь (рис. 5). Внешняя и внутренняя поверхности пузырька, между которыми находится вода, представляют собой смектические слои. Взаимное притяжение молекул мыла в поверхностных слоях создает необходимое для устойчивости пузыря поверхностное сцепление. Если размеры мыльного пузыря возрастают, то свободные молекулы мыла, находящиеся в жидкости, занимают места в слоях, увеличивая размеры поверхности пленки. Если пузырь сжимается, молекулы мыла выжимаются из слоев и переходят обратно в раствор жидкости [7].
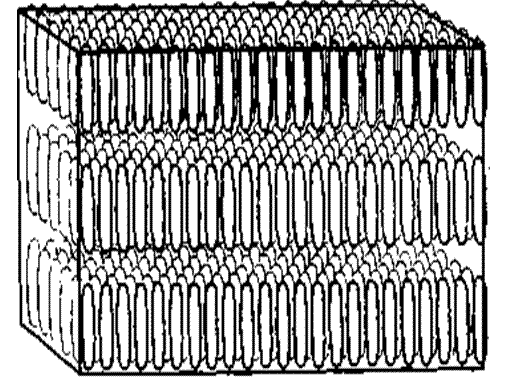
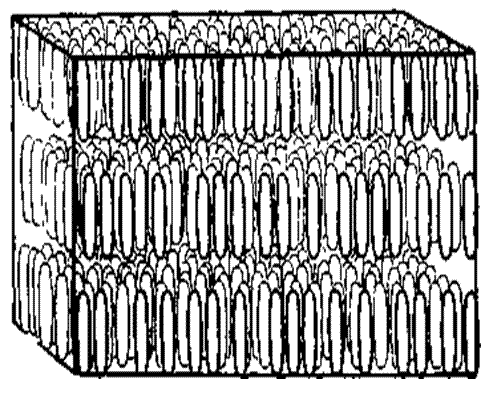
Рис. 4. Смектические жидкие кристаллы состоят из параллельных слоев, в которых молекулы в слое либо упорядочены в отдельные ряды (верхняя картинка), либо располагаются достаточно хаотично (нижняя картинка). Длинная ось всех молекул в каждом слое перпендикулярна плоскости слоя. Слои могут достаточно свободно скользить друг по другу, что приводит к появлению у такого вещества механических свойств двумерной жидкости.

Рис. 5. Поперечное сечение мыльного пузыря. Смектические жидкокристаллические слои образуют внутреннюю и наружную поверхности пузыря. Притяжение соседних молекул мыла в поверхностных слоях создает необходимое поверхностное натяжение в пузырьке. Если мыльный пузырь слегка раздувается, свободные молекулы мыла, находящиеся в жидкости между слоями, занимают места в слоях, увеличивая размеры поверхности пленки.
При наличии некоторого числа смектических слоев проявляется тенденция к дальнейшему упорядочению в том смысле, что концы молекул одного слоя должны определенным образом располагаться по отношению к концам молекул прилежащих слоев. Структура смектических слоев походит на твердый кристалл, в котором каждое направление в пространстве характеризуется порядком и повторением в расположении частиц. Однако для веществ в смектической фазе температура достаточно высока, чтобы ослабить связи между слоями, но не настолько высока, чтобы разрушить сами слои. Такие слои без помех скользят по подобным соседним слоям, в результате чего слой будет вести себя как двумерная жидкость.
С помощью поляризованного света, можно показать, что смектическое жидкокристаллическое вещество оптически ведет себя подобно двулучепреломляющему кристаллу, например такому, как кварц, у которого скорость света, распространяющегося перпендикулярно слоям, меньше, нежели скорость света, распространяющегося параллельно слоям. Другими словами, вдоль длинной оси молекулы свет распространяется с меньшей скоростью, чем поперек нее. Кристаллические структуры такого типа называются оптически положительными.
Второй класс жидкокристаллических веществ называется «нематическим» (от греческого «нема» — нить). Фридель выбрал это наименование по той причине, что такие вещества содержат микроскопические нитевидные структуры, концы которых либо свободны, либо прикрепляются к стенкам сосуда. Нематические жидкие кристаллы не настолько упорядочены, как смектические вещества. Хотя молекулы в нематической фазе упорядочены таким образом, что их длинные оси параллельны друг другу, они не собраны в отдельные слои. Как и смектические кристаллы, нематические кристаллы оптически положительны.
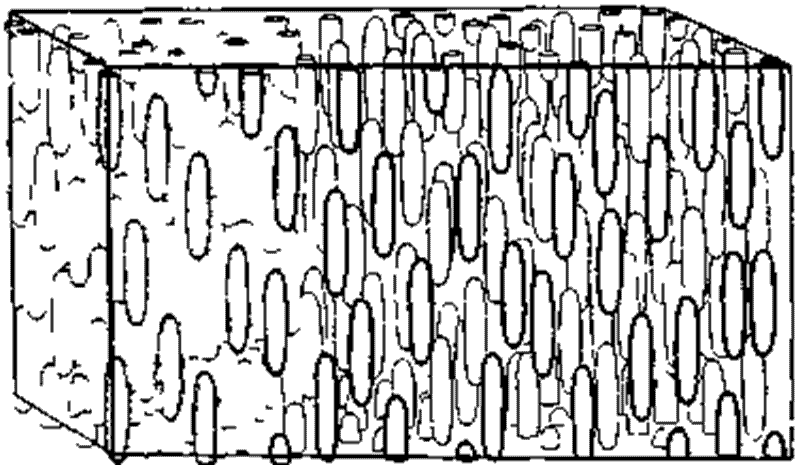
Рис. 6. Нематические жидкие кристаллы значительно менее упорядочены, нежели смектические вещества. Молекулы в них ориентированы так, что длинные оси их параллельны, однако молекулы уже не собраны в слои.
Молекулы типичного нематического вещества реагируют на электрическое и магнитное воздействие во многом так же, как реагируют железные опилки: уже очень слабые поля ориентируют их длинные оси параллельно друг другу. Так, например, можно повлиять на вязкость нематического материала просто прилагая слабое магнитное поле перпендикулярно направлению течения.
Третий класс жидких кристаллов Фридель назвал «холестерическим», поскольку их молекулярное строение характерно для большого числа соединений, содержащих холестерин, хотя сам по себе холестерин не имеет жидкокристаллической фазы. Молекулы в холестерических жидких кристаллах, как и в смектических жидких кристаллах, собраны в слои. Однако внутри каждого слоя параллельное друг другу расположение осей молекул более напоминает нематическую фазу (рис. 7). Молекулярные слои в холестерическом веществе очень тонки, поскольку длинные оси молекул параллельны плоскостям слоев. В противоположность смектическим и нематическим веществам, холестерические жидкие кристаллы оптически отрицательны, это означает, что скорость света, распространяющегося перпендикулярно молекулярным слоям, максимальна.
Каждая молекула в холестерических жидких кристаллах имеет в основном плоскую конфигурацию, к которой присоединены в качестве боковой цепочки метильные группы CH3, располагающиеся над и под плоскостью этой молекулы. Такая необычная конфигурация приводит к тому, что направление длинной оси молекулы в каждом слое слегка отклоняется от соответствующего направления в предыдущем слое. Это отклонение, составляющее примерно в среднем 15 дуговых минут на слой, накапливается по мере прохождения последовательности слоев, так что отклонение в целом описывает спираль.
Своеобразная молекулярная архитектура холестерических жидких кристаллов приводит к некоторым специфическим оптическим свойствам. Например, если линейно поляризованный свет пропускается перпендикулярно молекулярным слоям, то плоскость поляризации будет поворачиваться влево на угол, пропорциональный толщине вещества, пропускающего свет. Кристаллические вещества, вращающие плоскость поляризации света, называются оптически активными. Например, кристаллы альфа-кварца поворачивают плоскость поляризации света примерно на 20° на миллиметр толщины и считаются весьма активными. С другой стороны, оптически активное холестерическое вещество поворачивает плоскость поляризации на угол порядка 18 000°, что соответствует 50 полным оборотам на миллиметр. Жидкие кристаллы подобного типа являются наиболее оптически активными среди всех известных веществ [8].
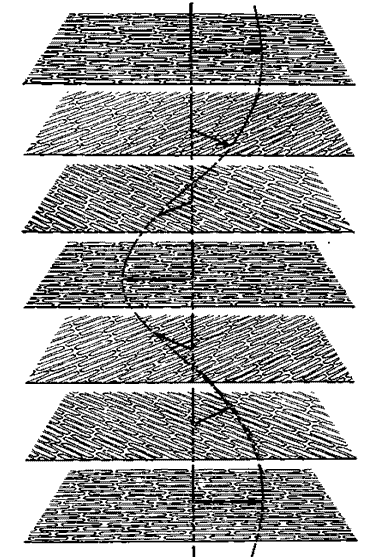
Рис. 7. Холестерические жидкие кристаллы напоминают смектические жидкие кристаллы, поскольку молекулы их собраны в слои, однако в каждом слое параллельное расположение молекул более сходно с нематической фазой. Из-за специфической формы молекул холестерина направление длинных осей молекул в каком-либо слое слегка отличается от соответствующего направления в последующем слое. Картина слоя повторяется после того, как совокупное отклонение описывает винтообразную траекторию.
Оптическим свойством, общим для всех трех типов жидкокристаллических веществ, является двойное лучепреломление (рис. 8). Когда луч белого света падает на поверхность двулучепреломляющего материала, он расщепляется на две поляризованные компоненты, направления колебаний которых перпендикулярны друг другу. Эти две компоненты распространяются с различными скоростями через двулучепреломляющий материал и, следовательно, преломляются под слегка различными углами. Они выходят из материала параллельными пучками, с взаимно перпендикулярными плоскостями поляризации. Одним из наиболее удобных методов идентификации жидкокристаллического вещества является проверка его на двойное лучепреломление.
Равновесие в молекулярной структуре холестерического жидкокристаллического вещества в может быть легко нарушено. Следовательно, любое малое возмущение, нарушающее слабые силы, действующие между молекулами, может привести к заметным изменениям в таких оптических свойствах, как отражение, пропускание, двойное лучепреломление, круговой дихроизм, оптическая активность и окраска. Вероятно наиболее впечатляющим оптическим превращением в холестерическом веществе при небольшом изменении в его структуре, является вариация окраски с температурой. Хотя большинство холестерических веществ бесцветны, как вода, они обнаруживают серию ярких перемен окраски по мере того, как эта жидкокристаллическая фаза охлаждается (рис. 9). В холестерическом состоянии в зависимости от температуры они могут быть вначале фиолетовыми, затем голубыми, затем зелеными, желтыми, красными и, наконец, когда максимум отражения перемещается в инфракрасную область, они становятся опять бесцветными. Дальнейшее охлаждение переводит эти вещества в смектическую фазу, которая также бесцветна [9].

Рис. 8. Когда пучок неполяризованного света попадает на двулучепреломляющее вещество, он расщепляется в две поляризованные составляющие, колебания в которых происходят в направлениях, перпендикулярных друг другу и располагающихся в плоскости, перпендикулярной направлению распространения этих компонент. Эти две компоненты преломляются в веществе под разными углами и выходят параллельными пучками поляризованного света.
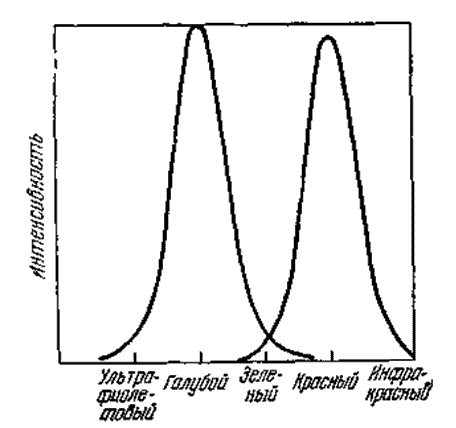
Рис. 9. Температура оказывает большое влияние на цвет холестерического жидкокристаллического вещества. В том случае, если вещество было вначале красным, то при подогреве оно становится голубым.
Не все холестерические жидкие кристаллы реагируют на изменения температуры подобным образом. Так, например, некоторые меняют свою окраску только от красной до зеленой; другие меняют от красной к зеленой и до голубой, или же от красной к зеленой, а затем опять становятся красными. Некоторые вещества вначале бывают голубыми и становятся при охлаждении зелеными, а затем красными. Имеются и такие вещества, которые вовсе не реагируют на изменение температуры. В любом случае существенным моментом является то, что при определенной температуре данное вещество или комбинация веществ, всегда обладает одним и тем же цветом. Следовательно, смешивая холестерические вещества в различных пропорциях, можно получить любую желаемую температурно-цветную комбинацию. Холестерические жидкие кристаллы используются в лабораториях для измерения колебаний температуры. Эти вещества изготовляются в виде пленок или лент с тем, чтобы можно было, прикладывая их к поверхности, регистрировать температурные перепады в различных направлениях [10].
В отличие от термотропных жидких кристаллов лиотропные жидкие кристаллы образуются при растворении ряда амфифильных соединений в определенных растворителях и имеют, как правило, более сложную структуру, чем термотропные жидкие кристаллы. Амфифильные соединения состоят из молекул, содержащих гидрофильные и гидрофобные группы. Такие соединения широко распространены в природе. Так, например, любая жирная кислота является амфифильной. Ее молекулы состоят из двух частей: полярной “головки” (СООН-группа) и углеводородного “хвоста” [CH3(CH2)n–]. Подобные соединения при растворении в воде, как правило, образуют мицеллярные растворы, в которых полярные головки торчат наружу, находясь в контакте с водой, а углеводородные хвосты, контактируя друг с другом, смотрят вовнутрь. Такие мицеллы и являются теми структурными элементами, из которых строятся лиотропные жидкие кристаллы. В отличие от термотропных жидких кристаллов, где формирование определенного типа мезофазы определяется лишь температурой, в лиотропных системах тип структурной организации определяется уже двумя параметрами: концентрацией вещества и температурой. Лиотропные жидкие кристаллы наиболее часто образуются биологическими системами, функционирующими в водных средах. Именно в этих системах в наиболее яркой форме проявляются уникальные особенности жидких кристаллов, сочетающих лабильность с высокой склонностью к самоорганизации. Ограничимся лишь одним примером, относящимся к клеткам и внутриклеточным органеллам, покрытым тонкими высокоупорядоченными оболочками – мембранами. Современные структурные исследования показывают, что мембраны представляют собой типичные лиотропные ламеллярные лабильные ЖК-структуры, составленные из двойного слоя фосфолипидов, в котором “растворены” белки, полисахариды, холестерин и другие жизненно важные компоненты. Такое анизотропное строение мембраны, с одной стороны, позволяет защищать ее внутреннюю часть от нежелательных внешних воздействий, а с другой стороны, ее “жидкостной” характер обеспечивает высокие транспортные свойства (проницаемость, перенос ионов и др.), что придает клетке определяющую роль в процессах жизнедеятельности [11].
Применение ЖК.
Одно из важных направлений использования жидких кристаллов — термография. Подбирая состав жидкокристаллического вещества, создают индикаторы для разных диапазонов температуры и для различных конструкций. Например, жидкие кристаллы в виде плёнки наносят на транзисторы, интегральные схемы и печатные платы электронных схем. Неисправные элементы — сильно нагретые или холодные, неработающие — сразу заметны по ярким цветовым пятнам. Новые возможности получили врачи: жидкокристаллический индикатор на коже больного быстро диагностирует скрытое воспаление и даже опухоль. С помощью жидких кристаллов обнаруживают пары? вредных химических соединений и опасные для здоровья человека гамма- и ультрафиолетовое излучения. На основе жидких кристаллов созданы измерители давления, детекторы ультразвука. Но самая многообещающая область применения жидкокристаллических веществ — информационная техника. От первых индикаторов, знакомых всем по электронным часам, до цветных телевизоров с жидкокристаллическим экраном размером с почтовую открытку прошло лишь несколько лет. Такие телевизоры дают изображение весьма высокого качества, потребляя ничтожное количество энергии от малогабаритного аккумулятора или батарейки [12].
7. Фуллерены.
Фуллерены — молекулярные соединения, принадлежащие классу аллотропных форм углерода (другие — алмаз, карбин и графит) и представляющие собой выпуклые замкнутые многогранники, составленные из чётного числа трёхкоординированных атомов углерода. Своим названием эти соединения обязаны инженеру и дизайнеру Ричарду Бакминстеру Фуллеру, чьи геодезические конструкции построены по этому принципу. Первоначально данный класс соединений был ограничен лишь структурами, включающими только пяти- и шестиугольные грани. Заметим, что для существования такого замкнутого многогранника, построенного из n вершин, образующих только пяти- и шестиугольные грани, согласно теореме Эйлера для многогранников, утверждающей справедливость равенства | n | - | e | + | f | = 2 (где | n | , | e | и | f | соответственно количество вершин, ребер и граней), необходимым условием является наличие ровно 12 пятиугольных граней и n / 2 - 10 шестиугольных граней.
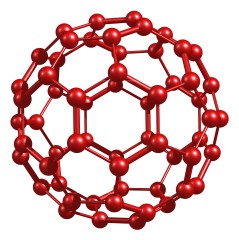
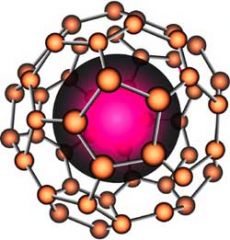
Рис. 10. Фуллерены.
Структурные свойства фуллеренов.
В молекулах фуллеренов атомы углерода расположены в вершинах правильных шести- и пятиугольников, из которых составлена поверхность сферы или эллипсоида. Самый симметричный и наиболее полно изученный представитель семейства фуллеренов — [60]фуллерен (C60), в котором углеродные атомы образуют многогранник, состоящий из 20 шестиугольников и 12 пятиугольников и напоминающий футбольный мяч. Так как каждый атом углерода фуллерена С60 принадлежит одновременно двум шести- и одному пятиугольнику, то все атомы в С60 эквивалентны, что подтверждается спектром ядерного магнитного резонанса (ЯМР) изотопа 13С — он содержит всего одну линию. Однако не все связи С-С имеют одинаковую длину. Связь С=С, являющаяся общей стороной для двух шестиугольников, составляет 1.39 А, а связь С-С, общая для шести- и пятиугольника, длиннее и равна 1.44 А. Кроме того, связь первого типа двойная, а второго — одинарная, что существенно для химии фуллерена С60. Следующим по распространённости является фуллерен C70, отличающийся от фуллерена C60 вставкой пояса из 10 атомов углерода в экваториальную область C60, в результате чего молекула C70 оказывается вытянутой и напоминает своей формой мяч для игры в регби. Так называемые высшие фуллерены, содержащие большее число атомов углерода (до 400), образуются в значительно меньших количествах и часто имеют довольно сложный изомерный состав. Среди наиболее изученных высших фуллеренов можно выделить Cn, n=74, 76, 78, 80, 82 и 84 [13].
Физические свойства и прикладное значение фуллеренов.
Фуллериты.
Конденсированные системы, состоящие из молекул фуллеренов, называются фуллеритами. Наиболее изученная система такого рода — кристалл С60, менее — система кристаллического С70. Исследования кристаллов высших фуллеренов затруднены сложностью их получения. Атомы углерода в молекуле фуллерена связаны σ- и π- связями, в то время как химической связи (в обычном смысле этого слова) между отдельными молекулами фуллеренов в кристалле нет. Поэтому в конденсированной системе отдельные молекулы сохраняют свою индивидуальность (что важно при рассмотрении электронной структуры кристалла). Молекулы удерживаются в кристалле силами Ван-дер-Ваальса, определяя в значительной мере макроскопические свойства твёрдого C60. При комнатных температурах кристалл С60 имеет гранецентрированную кубическую (ГЦК) решётку с постоянной 1.415 нм, но при понижении температуры происходит фазовый переход первого рода (Ткр≈260 К) и кристалл С60 меняет свою структуру на простую кубическую (постоянная решётки 1.411 нм). При температуре Т > Ткр молекулы С60 хаотично вращаются вокруг своего центра равновесия, а при её снижении до критической две оси вращения замораживаются. Полное замораживание вращений происходит при 165 К. Кристаллическое строение С70 при температурах порядка комнатной подробно исследовалось в работе. Как следует из результатов этой работы, кристаллы данного типа имеют объёмноцентрированную (ОЦК) решётку с небольшой примесью гексагональной фазы [14].
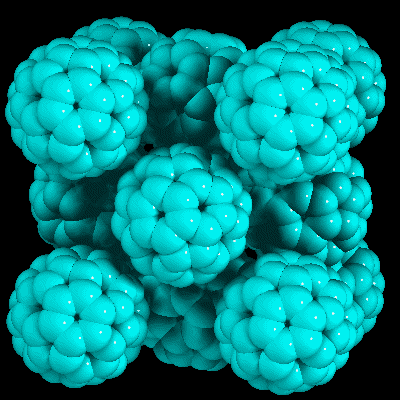
Рис. 11. Фуллерит.
Нелинейные оптические свойства фуллеренов.
Анализ электронной структуры фуллеренов показывает наличие π-электронных систем, для которых имеются большие величины нелинейной восприимчивости. Фуллерены действительно обладают нелинейными оптическими свойствами. Однако из-за высокой симметрии молекулы С60 генерация второй гармоники возможна только при внесении асимметрии в систему (например внешним электрическим полем). С практической точки зрения привлекательно высокое быстродействие (~250 пс), определяющее гашение генерации второй гармоники. Кроме того фуллерены С60 способны генерировать и третью гармонику. Другой вероятной областью использования фуллеренов и, в первую очередь, С60 являются оптические затворы. Экспериментально показана возможность применения этого материала для длины волны 532 нм. Малое время отклика даёт шанс использовать фуллерены в качестве ограничителей лазерного излучения и модуляторов добротности. Однако, по ряду причин фуллеренам трудно конкурировать здесь с традиционными материалами. Высокая стоимость, сложности с диспергированием фуллеренов в стёклах, способность быстро окисляться на воздухе, далеко не рекордные коэффициенты нелинейной восприимчивости, высокий порог ограничения оптического излучения (не пригодный для защиты глаз) создают серьёзные трудности в борьбе с конкурирующими материалами [15].
Фуллерен в качестве материала для полупроводниковой техники.
Молекулярный кристалл фуллерена является полупроводником с шириной запрещённой зоны ~1.5 эВ и его свойства во многом аналогичны свойствам других полупроводников. Поэтому ряд исследований был связан с вопросами использования фуллеренов в качестве нового материала для традиционных приложений в электронике: диод, транзистор, фотоэлемент и т. п. Здесь их преимуществом по сравнению с традиционным кремнием является малое время фотоотклика (единицы нс). Однако существенным недостатком оказалось влияние кислорода на проводимость плёнок фуллеренов и, следовательно, возникла необходимость в защитных покрытиях. В этом смысле более перспективно использовать молекулу фуллерена в качестве самостоятельного наноразмерного устройства и, в частности, усилительного элемента [16].
Фуллерен как фоторезист.
Под действием видимого (> 2 эВ), ультрафиолетового и более коротковолнового излучения фуллерены полимеризуются и в таком виде не растворяются органическими растворителями. В качестве иллюстрации применения фуллеренового фоторезиста можно привести пример получения субмикронного разрешения (≈20 нм) при травлении электронным пучком кремния с использованием маски из полимеризованной плёнки С60 [17].
Фуллереновые добавки для роста алмазных плёнок методом CVD.
Другой интересной возможностью практического применения является использование фуллереновых добавок при росте алмазных плёнок CVD-методом (Chemical Vapor Deposition). Введение фуллеренов в газовую фазу эффективно с двух точек зрения: увеличение скорости образования алмазных ядер на подложке и поставка строительных блоков из газовой фазы на подложку. В качестве строительных блоков выступают фрагменты С2, которые оказались подходящим материалом для роста алмазной плёнки. Экспериментально показано, что скорость роста алмазных плёнок достигает 0.6 мкм/час, что в 5 раз выше, чем без использования фуллеренов. Для реальной конкуренции алмазов с другими полупроводниками в микроэлектронике необходимо разработать метод гетероэпитаксии алмазных плёнок, однако рост монокристаллических плёнок на неалмазных подложках остаётся пока неразрешимой задачей. Один из возможных путей решения этой проблемы — использование буферного слоя фуллеренов между подложкой и плёнкой алмазов. Предпосылкой к исследованиям в этом направлении является хорошая адгезия фуллеренов к большинству материалов. Перечисленные положения особенно актуальны в связи с интенсивными исследованиями алмазов на предмет их использования в микроэлектронике следующего поколения. Высокое быстродействие (высокая насыщенная дрейфовая скорость); максимальная, по сравнению с любыми другими известными материалами, теплопроводность и химическая стойкость делают алмаз перспективным материалом для электроники следующего поколения [18].
Сверхпроводящие соединения с С60.
Как уже говорилось, молекулярные кристаллы фуллеренов — полупроводники, однако в начале 1991 г. было установлено, что легирование твёрдого С60 небольшим количеством щелочного металла приводит к образованию материала с металлической проводимостью, который при низких температурах переходит в сверхпроводник. Легирование С60 производят путём обработки кристаллов парами металла при температурах в несколько сотен градусов Цельсия. При этом образуется структура типа X3С60 (Х — атом щелочного металла). Первым интеркалированным металлом оказался калий. Переход соединения К3С60 в сверхпроводящее состояние происходит при температуре 19 К. Это рекордное значение для молекулярных сверхпроводников. Вскоре установили, что сверхпроводимостью обладают многие фуллериты, легированные атомами щелочных металлов в соотношении либо Х3С60, либо XY2С60 (X,Y — атомы щелочных металлов). Рекордсменом среди высокотемпературных сверхпроводников (ВТСП) указанных типов оказался RbCs2С60 — его Ткр=33 К. Влияние малых добавок фуллереновой сажи на антифрикционные и противоизносные свойства ПТФЭ Следует отметить, что присутствие фуллерена С60 в минеральных смазках инициирует на поверхностях контртел образование защитной фуллерено-полномерной пленки толщиной - 100 нм. Образованная пленка защищает от термической и окислительной деструкции, увеличивает время жизни узлов трения в аварийных ситуациях в 3-8 раз, термостабильность смазок до 400-500 гр. С и несущую способность узлов трения в 2-3 раза, расширяет рабочий интервал давлений узлов трения в 1,5-2 раза, уменьшает время приработки контртел [19].
Другие области применения фуллеренов.
Среди других интересных приложений следует отметить аккумуляторы и электрические батареи, в которых так или иначе используются добавки фуллеренов. Основой этих аккумуляторов являются литиевые катоды, содержащие интеркалированные фуллерены. Фуллерены также могут быть использованы в качестве добавок для получения искусственных алмазов методом высокого давления. При этом выход алмазов увеличивается на ≈30 % [20]. Фуллерены могут быть также использованы в фармации для создания новых лекарств [21]. Кроме того, фуллерены нашли применение в качестве добавок в интумесцентные (вспучивающиеся) огнезащитные краски. За счёт введения фуллеренов краска под воздействием температуры при пожаре вспучивается, образуется достаточно плотный пенококсовый слой, который в несколько раз увеличивает время нагревания до критической температуры защищаемых конструкций. Так же фуллерены и их различные химические производные используются в сочетании с полисопряжёнными полупроводящими полимерами для изготовления солнечных элементов [22].