Структура аморфных материалов и природа дефектов в них
V. ПРИМЕСНЫЕ ТОЧЕЧНЫЕ ДЕФЕКТЫ В КРИСТАЛЛАХ И АМОРФНЫХ МАТЕРИАЛАХ
Примесные дефекты могут быть как в кристаллических, так и в аморфных материалах, и представляют собой элементы, не входящие в состав материала. Они классифицируются по методу встраивания в структуру как дефекты внедрения и дефекты замещения [11,41].
Примеси замещения заменяют частицы основного вещества в узлах решетки, встраиваясь в нее тем легче, чем ближе атомные (ионные или молекулярные) радиусы примесного и матричного элементов, и подразделяются на две основные группы [27,42].
К первой группе
относятся примесные атомы, электронная структура которых подобна
электронной структуре атомов, входящих в состав основного вещества. В этом
случае они не нарушают мотив идеальной структуры кристалла или сетки
стеклообразного материала, но в силу различия в атомных размерах могут создать
либо короткодействующие поля упругих искажений, если атомные размеры близки,
либо дальнодействующие поля упругих искажений при значительной разнице в радиусах.
Второй широко распространенной группой дефектов замещения являются атомы, которые в ином зарядовом состоянии (обычно отличающемся на 1), чем атомы основного вещества, имеют изоэлектронную с ними структуру. Такие атомы при идеальном встраивании в решетку или сетку основного материала должны отдавать избыточный носитель заряда в его энергетические зоны (легирование полупроводников) или находящимся поблизости компенсаторам заряда, которыми могут служить другие примесные или собственные точечные дефекты. В последнем случае расчет таких примесных дефектов усложняется.
Примеси внедрения занимают междоузлия, внедряясь в решетку тем легче, чем больше объем пространства между атомами. В класс дефектов внедрения обычно входят атомы инертных газов, молекулы газов, атомы переходных элементов, то есть химически менее активные примеси, чем те, что образуют дефекты замещения. Плотности таких дефектов зависят от природы аморфного материала или кристалла. Как правило, в аморфных материалах есть достаточно большие междоузельные позиции, в которых они могут разместиться, слабо взаимодействуя с атомами матрицы. В силу этого примесные дефекты внедрения легко диффундируют в структуре основного вещества. В стеклообразной неупорядоченной сетке SiO2 такими областями являются кольца из 7 и 9 тетраэдров (рис.6 а, б).
В некристаллических материалах возникает третий класс примесных дефектов, характерный только для них: примесные атомы частично встраиваются в структуру основного вещества, насыщая оборванные связи. Обычно это одновалентные примеси. Такие частично встроенные в матрицу основного вещества примесные дефекты имеют промежуточную по величине между дефектами замещения и дефектами внедрения силу связи с ней. Поэтому они чувствительны к внешним воздействиям, и их концентрации и зарядовые состояния зависят не только от степени легирования исходного сырья, но и от технологии приготовления аморфных веществ и последующих обработок (отжиг, облучение и т.д.). Во многих случаях именно частично встроенными в сетку примесными точечными дефектами обусловлено различие в физических характеристиках кристаллического и стеклообразного состояния веществ с одинаковыми химическими составами. В частности, при введении в сетку аморфного SiO2 молекул М О, где М - атом щелочного элемента, возникают кислородно-дырочные центры [26].
Присутствие в SiO2 иновалентных катионов (Na, K, H и др.) приводит также к появлению кислородных дефектов, называемых междоузельным кислородом (рис.15 в).
Наиболее часто распространенными примесными дефектами третьего типа являются водородные сеточные дефекты [19,26].
Они возникают в аморфных веществах во время роста окисла при участии водорода и воды и/или при термообработке после окисления. Во процессе роста окисла при химической реакции с участием воды, а именно:
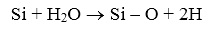 (14)
(14)
водород выделяется на поверхности раздела Si-SiO2, что может приводить к образованию групп SiH с атомами кремния Si на поверхности, имеющими оборванную связь :
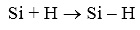 (15)
(15)
Дефекты внедрения в сетку аморфного SiO
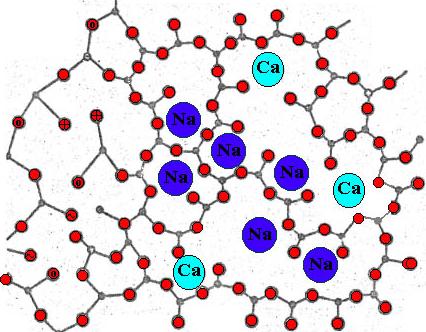
Si атом, О атом, замещение атома кремнияпятивалентной примесью, замещение атома кремния трехвалентной примесью, замещение межузельного кислорода моновалентным анионом (например, ОН), немостиковаякислородная вакансия, немостиковый кислород).
Данная реакция протекает на поверхности Si при средних температурах (≈500oС). При высоких температурах ( Т≈1000oС ) водород реагирует с сеткой SiO2 и приводит к появлению трехвалентных групп:
 (16)
(16)
Схематически конфигурацию атомов Si и O в сетке SiO2 можно изобразить следующим образом:
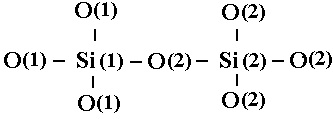 (17)
(17)
Образование Н-связанных дефектов рассматривают как разрыв связи О(2)-Si(2) и присоединение атома Н к О(2) с возникновением Si(1)-О(2)Н и трехвалентного кремния Si(2)
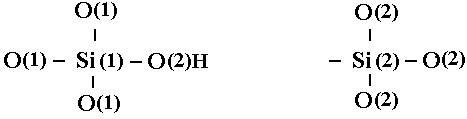 (18)
(18)
или как разрыв связи Si(1)-О(2) с образованием Si(1)-Н и немостикового кислорода в группе O(2)-Si(2).
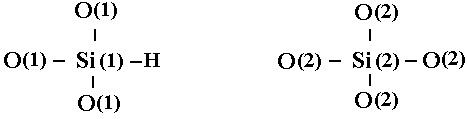 (19)
(19)
И трехвалентный кремний, и немостиковый кислород представляют собой собственные сеточные дефекты в аморфном SiO2.
В группе Si(2)-ОН водород ведет себя как акцептор электрона, так как замена Si(2) на Н изменяет электроотрицательность на +0.3. (Величины электроотрицательности для Si, О и Н равны 1.8, 3.5 и 2.1 соответственно). Вследствие этого, донорный характер связи Si(1)-О(2) уменьшается, выражаясь в возрастании длины связи до 1.68 А. Как результат ослабления связи между Si(1) и О(2), 3d-орбитали Si(1) лучше перекрываются с орбиталями мостиковых атомов кислорода О(1)(со всеми оставшимися тремя), так что эти связи усиливаются. В итоге имеет место возрастание угла связи Si(1)-O(1)-Si(1) и сжатие тетраэдра SiO4/2, что проявляется в увеличении плотности пленок SiO2, выращенных при высоком давлении.
Ситуация становится обратной, когда водород образует связь Si(1)-H. В этом случае водород ведет себя как донор электронов, так как замена О(2) на Н эквивалентна изменению электроотрицательности на -1.4. Следовательно, связь Si(1)-O(1)-Si(1) в соответствующих тетраэдрах ослабляется.
Поступление водорода из воды приводит к образованию аналогичных дефектов. Взаимодействие с водой может протекать через следующие реакции [19,26]:
1. Гидроксильная группа или вода может реагировать с
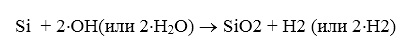 (20)
(20)
2. Вода может реагировать с Si-O-Si связями сетки с образованием Si-OH групп путем реакции 1:
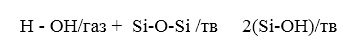 (21)
(21)
однако во время последующей термообработки Si-O-Si связи могут восстанавливаться путем реакции 2. Если время отжига достаточно велико, Н2О может удаляться из окисла.
3. Водород может высвобождаться путем реакции 2:
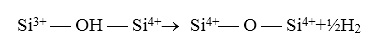 (22)
(22)
В этом случае трехвалентный Si можно рассматривать как "локальное восстановление" сетки SiO2-X.
4. Водород может играть роль катализатора в реакции воды с кремниевой подложкой во время роста окисла.
Непосредственное внедрение водорода в SiO2 может происходить также во время отжига после окисления в чистом Н2 или в смеси Н2 и N2 при температурах выше 500oС; во время отжига после металлизации в тех же атмосферах при температурах ниже 500oС; при получении окисла на кремнии путем реакций, проводимых при участии SiH4.
Группы Si-Н и Si-ОН могут быть выявлены методом ИК-поглощения и ядерного резонанса. Термические окислы SiO2 содержат от 5·1015 до 2·1019 см-3 групп Si-H. Эти значения зависят от условий окисления и последующих отжигов. Показано, что в "ультрасухих" окислах содержание Н2О составляет 1.3·1018 см-3, в то время как количество Si-H и Si-ОН 6·1015 см-3 и 5·1017 см-3, соответственно [19].
а) Если мы оставим воду диффундировать в такой системе, то концентрации Н2О и Si-H останутся постоянными, а количество Si-ОН возрастет до 1.2·1019 см-3.
б) Если отжечь такие окислы в неокислительной среде, то есть в N2 или в смеси Н2 (10%) и N2 (90%), то количество Si-ОН уменьшается, а Н2О возрастает.
Кроме рассмотренных выше существует еще ряд атомных конфигураций, в которых водород связан с сеткой SiO2. С энергетической точки зрения наиболее предпочтительными являются конфигурации, в которых Н занимает узел, классифицированный выше как кислородная вакансия. Некоторые наиболее вероятные из них представлены на рис.21 вместе с результатами расчета энергетической зонной структуры для кластеров из двух групп SiO2, содержащих один или два атома водорода. Эти расчеты показали, что энергетические уровни, обусловленные водородными дефектами, могут лежать в запрещенной зоне.
Вверху: некоторые атомные конфигурации; внизу: уровни энергии, рассчитанные для протранслированных “SiO2 – кластеров”, содержащих один или 2 атома водорода [19]

Рис.21 а иллюстрирует кластер, состоящий из двух молекул SiO2 и одного атома водорода, занявшего бывшую Si-O связь. Волновая функция наивысшего занятого уровня соответствует в этом случае группе ОН.
Если кластер из восьми молекул содержит два атома водорода (рис.21 б), то волновая функция наивысшего занятого уровня в основном локализована на водородной компоненте Si-H группы, но распространяется и на три ближайших к Н атома кислорода. Этот дважды занятый центр электрически нейтрален и сравним по энергии с энергией, соответствующей двум междоузельным атомам водорода, внедренным в нормальную решетку.
В случае, когда кластер из двух молекул содержит один атом водорода, занимающий узел, классифицированный как кислородная вакансия и находящийся на одинаковом расстоянии от атомов кремния (рис.21 в), наивысший занятый уровень является одиночным и состоит из p-орбиталей кремния. Добавление атома водорода частично расщепляет уровень, соответствующий кислородной вакансии. Ионизированный дефект такого типа требует меньших затрат энергии на образование, чем ионизированный междоузельный водород плюс кислородная вакансия.
Кластер из восьми молекул SiO2 может содержать два атома водорода, связанных с кислородной вакансией (рис.21 г). Если сравнить суммарную энергию такого комплекса и междоузельного кислорода с аналогичной энергией совершенного кристалла и междоузельного водорода, то оказывается, что образование одного центра, содержащего два атома водорода, требует меньших затрат энергии, чем образование двух центров, содержащих по одному атому водорода.
Наконец, можно построить кластер из восьми молекул SiO2, содержащих два атома водорода и два атома кислорода на разорванных Si-O связях (рис.21 д). Он может возникнуть при наличии в сетке аморфного SiO2 междоузельного кислорода (возникшего в результате образования поблизости вакансии) и междоузельного водорода или после добавления Н2О в сетку. Занятый уровень, лежащий чуть выше уровня края валентной зоны, состоит главным образом из р-орбиталей атома кислорода.
Хотя сами по себе Si-Н и Si-ОН группы не проявляются как электронные дефекты, они могут являться центрами захвата носителей (ловушками) при разрыве связи под действием напряжений или ионизирующего излучения.
Рассмотрим действие ионизирующего излучения на двуокись кремния, содержащую группу ОН (рис.22).
Иллюстрация поведения Si-ОН группы как центра захвата носителей заряда [19]
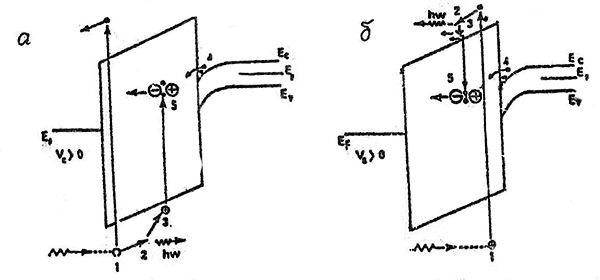
а механизм захвата дырки; б то же для электрона.
На 1-м этапе падающее ионизирующее излучение создает электронно-дырочную пару в окисле кремния, то есть связанный электрон из валентной зоны эмитирует в зону проводимости. Генерированные таким образом (или инжектированные) носители могут иметь очень высокие энергии. В этом случае (2-й этап) они термализуются, то есть теряют свою энергию на создание фотонов или плазменных осцилляций (могут быть также генерированы вторичные электронно-дырочные пары). На 3-м этапе термализованные дырки рекомбинируют с электроном на ОН ионе в Si:ОН центре:
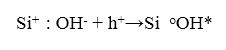 (23)
(23)
В результате рекомбинации Si-ОН связь разрывается, и возникает полностью нейтральная ОН группа в возбужденном состоянии, то есть источником внешнего потенциала становится трехвалентный кремний:
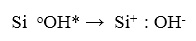 (24)
(24)
На следующем этапе (4-м) два свободных электрона, инжектированные из зоны проводимости кремния, будут реагировать с Si + ОН группой скорее последовательно, чем одновременно: первый электрон, взаимодействуя с нейтральным ОН радикалом, дает ион ОН-, который может дрейфовать прочь:
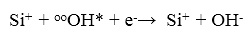 (25)
(25)
Второй электрон будет захвачен положительно заряженным трехвалентным кремнием, нейтрализуя его следующим образом:
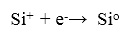 (26)
(26)
Отрицательно заряженный ОН- ион будет дрейфовать по направлению к положительно заряженному электрoду (5 й этап).
Встает вопрос: равновероятен ли захват электронов и дырок на рассматриваемой группе? Оказывается, Si:ОН центр менее способен захватывать электрон, чем дырку, так как свободный электрон в SiO2 более подвижен. Поэтому 3-й этап легче реализуется в эксперименте (хотя и зависит от его условий).
Рассмотренный выше механизм, при реализации которого связь Si-OН разрывается и высвобождается группа ОН, можно суммировать с помощью глобальной реакции:
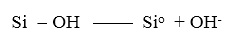 (27)
(27)
Как видно, механизм захвата достаточно сложен. Последняя реакция может также иметь место в объеме SiO2 и генерировать положительно заряженный трехвалентный Si (донор). Однако, ни захват дырок, ни эмиссия ловушечных электронов, после их захвата на ловушки, не могут сами по себе создать отрицательно заряженный ион ОН. Электроны должны быть инжектированы (например, путем туннелирования по Фаулеру Нордхейму), чтобы последняя реакция была возможна.
Атом и ион водорода очень мобильны в SiO2 и могут образовывать Si-Н группы с болтающимися связями Si как на поверхности так и в объеме. Si-Н связь может быть затем разорвана только при внешних воздействиях: облучение, поле + температура и т.д.
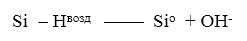 (28)
(28)
При наличии большого количества таких связей могут возрастать плотность поверхностных состояний (образование Si), и заряд в окисле (наличие ионов Н). В целом как Si-Н, так и Si-ОН группы ведут себя как донорные ловушки.
Описанные выше дефекты обусловлены именно наличием водорода, даже если он был внедрен в решетку из воды. Атомная и электронная структура таких дефектов хорошо известна и/или может быть смоделирована. Рассматриваемые далее дефекты имеют две особенности: они связаны с присутствием в окисле воды, и они также являются ловушками. Их обычно разделяют на две категории: глубокие и мелкие [19].
Рассмотрим связанные с наличием в окисле SiO2 воды глубокие ловушки, названные так потому, что их освобождение требует энергии фотона выше 4 эВ. В таблице 4 суммированы результаты экспериментальных исследований окисных пленок SiO2, проведенных методами ИК-спектроскопии и путем измерения электрических характеристик. Для удобства тип глубоких ловушек обозначен в табл.4 как А, В, С, Д.
Все глубокие ловушки первоначально нейтральны и могут быть обнаружены только при заполнении их носителями заряда. Механизм, по которому связанные с водой глубокие ловушки захватывают носители, еще противоречив. Считается, что в результате такого захвата могут происходить изменения и в кристаллической структуре материала, и в химсоставе дефекта. Установлено, что глубокие ловушки, обусловленные наличием в образцах воды, чувствительны к термообработке при низких температурах (220оС) во влажной атмосфере. В то же время в заполненном состоянии они нечувствительны к электрическим полям ниже 5·106 В/см. В содержащем воду окисле SiO2 глубокие ловушки электронов имеют поперечное сечение захвата ≈1.5·10-17 см2, а их пространственное распределение подчиняется экспоненциальному закону, возрастая от поверхности раздела Si-SiO2 к внешней поверхности окисла. Пока электроны остаются сильно захваченными (они не могут быть освобождены даже под действием столь высокого как 5·106 В/см электрического поля), они вызывают реакцию типа
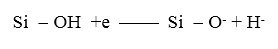 (29)
(29)
Отрицательный пространственный заряд может быть термически отожжен в присутствии паров воды при низких температурах (200оС) с энергией активации 0.35 эВ, близкой к энергии, соответствующей диффузии воды при этой температуре.
Таблица 4
Характеристики связанных с водой ловушек, измеренные для окисла SiO2 толщиной 50 нм, выращенного при 1000оС [19]
|
Символ дефекта |
Измеренное поперечное сечение σc см2 |
Измеренная эффективная плотность Nэф, см-2 |
Глубокие (Гл) или мелкие (М) |
Примечание |
|
A |
9∙10-20 |
6∙1020 |
Гл |
Наблюдаются всегда, независимо от способа получения |
|
B |
4<σc<5∙10-20 |
1<Nэф<4∙1020 |
Гл |
Наблюдаются всегда.Их плотность возрастает после термообработки в атм. кислорода |
|
C |
2<σc<4∙10-20 |
5<Nэф<15∙1020 |
Гл |
Наблюдаются только после отжига в безкислор. атм. |
|
D |
7<σc<10∙10-20 |
1<Nэф<2∙1020 |
Гл |
Наблюдаются только, eсли образцы не были отожжены в атм. кислорода |
|
E |
2∙10-16 |
5∙1011 |
М |
Nэф уменьшается после термообработки в кислороде |
|
F> |
1∙10-15 |
3∙1011 |
М |
Nэф возрастает после термообработки в кислороде |
|
G |
4∙10-15 |
1∙1011 |
М |
Показано, что пространственное распределение глубоких ловушек, связанных с водой, зависит от того, как получены слои окисла кремния:
1) для образцов окисла, выращенного в сухой атмосфере, помещенных затем во влажную атмосферу (PH2O = 50 Тор, Т = 150oС, t=10 м), плотность ловушек NTT см-2 и центр расположения заряда х (нм) изменяются с толщиной окисла tox согласно следующему эмпирическому закону:
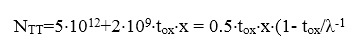 , (30)
, (30)
где λ - характеристическая длина диффузии для молекулы воды.
2) для образца, окисел на котором выращен в сухой атмосфере, то есть в атмосфере О2, содержащего приблизительно 0.5% H2O, концентрация [Si-OH] примерно постоянна в объеме слоя, но заметно возрастает как вблизи поверхности пленки, так и вблизи границы раздела Si-SiO2. Вероятно, группы, cвязанные с водой, фиксируются с помощью собственных дефектов, в частности, - Si , присутствующих в большом количестве в этих областях.
Нет экспериментальных данных, которые бы подтверждали, что Si-H группы могут вести себя как ловушки при отсутствии внешних воздействий: число Si-H связей обычно меньше, чем 1016 см-3, то есть слишком низко, чтобы можно было различить их на фоне других центров путем измерения электрических характеристик. Наличие групп Si-H было установлено методом ИК-спектроскопии и, по-видимому, их количество возрастает вблизи границы раздела Si-SiO2.
Характер зависимости величины σc от условий роста, от последующей термообработки и от метода наблюдения позволил сделать вывод, что ловушки, обозначенные С(2 < σc < 4·1018см-2), связаны с H2O; а ловушки, обозначенные D, связаны с Si-OH группами ( 7 < σc < 10·1018см-2) [19].
С присутствием в аморфном SiO2 воды связано появление, наряду с глубокими, нескольких типов мелких ловушек (E,F,G, табл.4), которые всегда пусты при комнатной температуре (термоосвобождены) и заполняются при низких температурах.
Мелкие ловушки энергетически локализованы на 0,3 эВ ниже дна зоны проводимости Eс окисла SiO2. Их σc относительно велико: 2·10-16см-2, 1·10-16см-2, 4·10-15см-2.
Ловушки такого типа обнаруживаютcя в окислах SiO2, полученных различными методами: сухим, влажным или с использованием HCl в различных концентрациях. Они также могут создаваться при отжиге структур металл-окисел-полупроводник с Al затворами и затворами из поликристаллического кремнияв атмосфере О2.
Предполагается, что как ловушки E,F,G, так и ловушки В, связаны в SiO2 с гомогенно распределенным трехвалентным кремнием, возникшим или из-за потери кислорода, или из-за выделения воды из сетки SiO2 в инертную среду. Следовательно, можно предполагать, что природа таких центров, как ловушек, связана с дефицитом кислорода в сетке, и они должны отжигаться в кислородной среде.
Именно термообработка в кислороде и оказалась одним из способов дифференциации мелких и глубоких ловушек. Как показали эксперименты, эффективная плотность ловушек Е и F (табл.4) заметно возрастает уже после 30-секундного отжига в кислороде при высокой температуре, тогда как число ловушек С не изменяется. В то же время кратковременная обработка в кислороде влияет и на глубокие ловушки В: их концентрация уменьшается и стабилизируется после 30 сек., но это уменьшение более быстрое, чем для ловушек Е и F. На другие ловушки указанная термообработка не влияет.
Примесные дефекты взаимодействуют с созданными радиацией элементарными электронными возбуждениями, проявляясь как центры окраски (ловушки ) или рекомбинации [10].
Доля n' общей концентрации примесных дефектов Nпр, перешедших в другое зарядовое состояние при облучении при t→К (стационарный случай), равна:
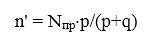 (31)
(31)
Если q>>p, то N >>n', то дефекты выступают как центры рекомбинации. При q = 104·p, n' = Nпр·10-4, и если Nпр≈1017, то n'≈1013, что ниже предела чувствительности оптических и спектроскопических методов исследования. Как центры окраски, дефекты проявляются, когда q=p и n'≈Nпр/2.
Примесные дефекты, создающие при облучении центры окраски, будут изменять конечные соотношения между дырочными и электронными центрами окраски. Примесные дефекты, являющиеся центрами рекомбинации, будут снижать количество носителей в зонах и интенсивность люминесценции, связанной с рекомбинацией носителей. Они образуют новые полосы свечения, обусловленные рекомбинацией на них элементарных электронных возбуждений [10].
В таблице 5 приведены результаты исследования красного свечения облученных образцов стекол SiO2 с различным содержанием примесей щелочных металлов и гидроксила.
Таблица 5
Интенсивность полосы фотолюминесценции, наблюдающейся при 1.9 эВ, при облучении стекол различного состава нейтронами и рентгеновскими лучами [10].
|
Тип стекла |
Концентрация при сей, вес. % |
Интенсивность полосы фотолюминесценции при 1.9 эВ, отн.един. |
|||
|
Щелочные металлы |
гидроксил |
нейтроны |
Рентген. лучи |
Рентген. лучи |
|
|
T=400 K |
T=300 K |
T=90 K |
|||
|
1 |
10-3 |
10-4 |
200 |
30 |
<5 |
|
2 |
10-3 |
10-2 |
200 |
10 |
60 |
|
3 |
10-4 |
10-1 |
1000 |
<5 |
800 |
|
4 |
10-4 |
10-4 |
4000 |
<5 |
<5 |
|
Доза облучения составляла для рентгеновских лучей 106 Р для нейтронов: для стекол типа 1 и 2 - 1016 n /см2; для стекол типа 3 и 4 - 1018 n /см2 . |
|||||
Из данных табл.4 следует, что рентгеновское облучение создает центры красной люминесценции только в стеклах, содержащих одновалентные примеси: водород в виде гидроксила или щелочные металлы. Показано [10], что и в том, и в другом случае центрами красной люминесценции служит немостиковый кислород Онм.
При низкотемпературном рентгеновском облучении он создается в результате разрыва связей O-H путем реакции типа:
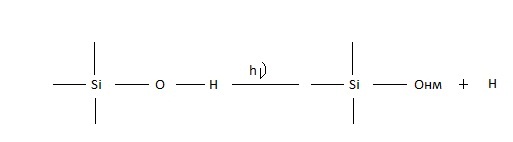 (32)
(32)
Образующийся при этом атом Н стабилизируется в междоузлии сетки стекла SiO2. Возникшие дефекты Онм термически нестабильны и разрушаются при нагреве до температуры 300 К.
Отмечается [10], что образование термически нестабильных Онм-центров имеет место только в тех образцах, которые содержат гидроксильные группы.
В стеклах, содержащих повышенное количество металлических примесей (1 и 2 в табл.4), концентрация появляющегося при облучении рентгеновскими лучами при 300 К Онм коррелирует с концентрацией щелочных элементов [10]. Следовательно, Онм возникает при высвобождении атома металла М из группировки S i O М и размещения его в междоузлии:
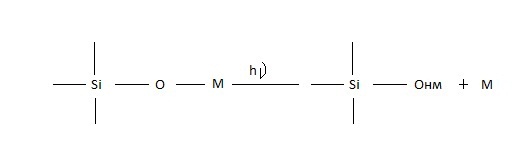 (33)
(33)
Облучение нейтронами наводит центры красной люминесценции в любом образце SiO2 независимо от концентрации примесей, и анализ данных говорит о том, что это собственные дефекты SiO2. Следовательно, при облучении частицами высоких энергий наличие примесных дефектов играет гораздо меньшую роль в общем механизме дефектообразования, чем при облучении рентгеновскими лучами.
Как примесные, так и собственные дефекты в аморфных материалах и в особенности в пленках возникают в первую очередь как дефекты роста. Их концентрации должны зависеть от условий и способа синтеза и оказывать влияние как на физические свойства самих материалов, так и на стабильность и надежность устройств, созданных на их основе. Однако оказалось, что метод и условия получения аморфных пленок определяют не только их дефектность, но и тип ближнего порядка, поэтому необходимо в каждом отдельном случае проводить исследования атомной структуры объекта. Рассмотрим результаты таких исследований на примере аморфных окисных пленок кремния и нитрида кремния.