Структура аморфных материалов и природа дефектов в них
III.СОБСТВЕННЫЕ СЕТОЧНЫЕ ДЕФЕКТЫ В АМОРФНОМ ОКИСЛЕ SiO2
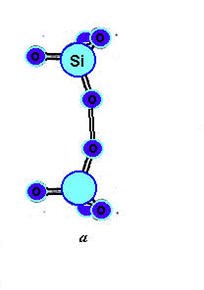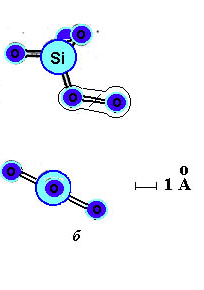
К собственным сеточным дефектам в аморфном SiO2 относят следующие нарушения структуры [19]: Растянутая Si-O связь: угол связи между тетраэдрами φ изменяется от 154о - среднего значения для идеальной неупорядоченной сетки [18] - до 180о, а центральный атом кислорода смещается из своего исходного положения так, что расстояние Si-O-Si достигает = 3.2 Å (рис.8). Из эксперимента [9,18] известно, что наиболее вероятное значение расстояния Si-O в некристаллическом SiO2 составляет 1.61-1.62 Å, а наиболее вероятное расстояние Si-O-Si=3.06 Å Растяжение Si-O-Si связи приводит к возникновению небольшого дипольного момента. Средний дипольный момент составляет всего 0.5 Дебая (или 0.1 e Å), что соответствует смещению единичного заряда только на 0.1 A [19].
Напряженная Si-O связь: напряженные связи (рис.9 а) отличаются от растянутых наличием возмущенных орбиталей.
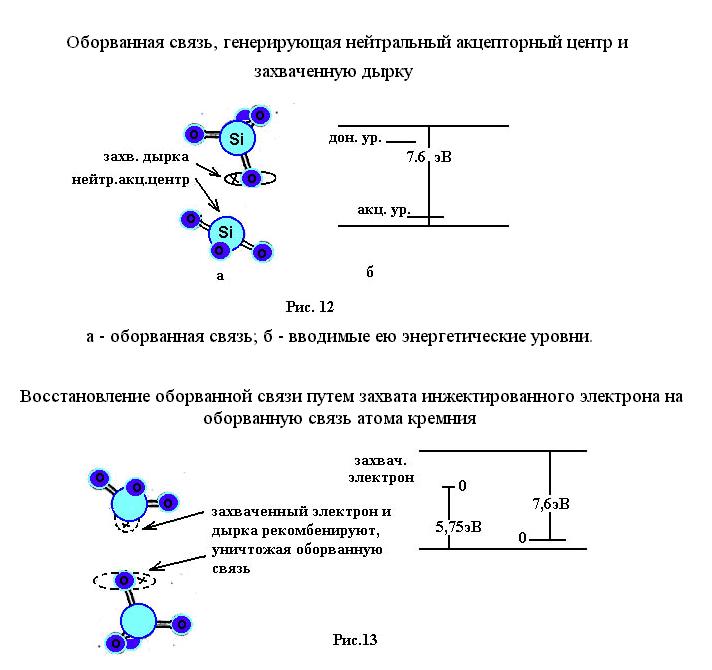
Оборванные и болтающиеся связи: это связи, у которых орбитали соседних атомов не перекрываются (рис.9 б,в) из-за возникновения смещения атомов кислорода и кремния такого, что длина связи Si-O-Si становится больше 3.2 А, то есть связь между соседними тетраэдрами разрушается. При этом на свободную кремниевую связь может захватываться электрон (рис.9б), а на кислородную - дырка (рис.9 в). Термин "болтающаяся" (Si+ или О-) связь означает единичную оборванную связь на поверхности окисла.
Si-O связи в кристаллическом и аморфном SiO2
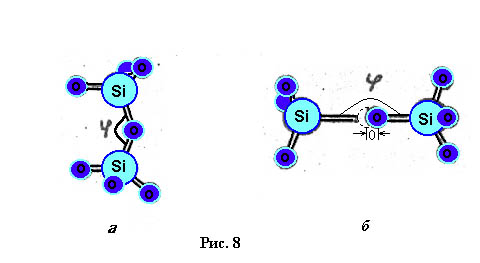
а - нормальная связь Si-O-Si в a-кварце; б - растянутая Si-O-Si связь в аморфном SiO2. При растяжении связи происхдит смещение атома кислорода из центрального положения.
Оборванные связи возникают при слишком быстром протекании процесса роста окисла. Рис 10. иллюстрирует некоторые дефекты типа вакансий в упорядоченной структуре из атомов разного сорта и встроенные в сетку неупорядоченного материала дефекты типа оборванных связей.
Все указанные дефекты влияют на физические свойства и на зонную структуру аморфных твердых тел, вводя дополнительные уровни в запрещенную зону.
Напряженные и оборванные Si-O-Si связи в аморфном SiO2
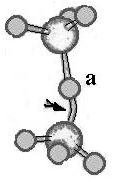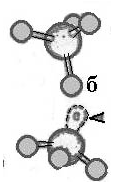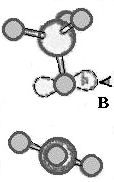
а - напряженная Si-O-Si связь, стрелкой указана возмущенная орбиталь; б - оборванная Si-O-Si связь с захваченным электроном (e); в - оборванная Si-O-Si связь с захваченной дыркой (h).
Дефекты в кристаллической и аморфной фазах

а - вакансии в кристалле; б - оборванные связи в неупорядоченной сетке.
Установлено [19], что наличие напряженных связей приводит к смещению края поглощения ультрафиолета к более низким значениям энергии. Это коррелирует со смещением потолка валентной зоны EV в аморфном SiO2 по сравнению с кристаллическим на 0.4 эВ. Край валентной зоны размывается (рис.11), так как искаженные связи вводят непрерывные уровни вблизи EV, что четко фиксируется при аморфизации кристаллического SiO2. Косвенным подтверждением распределения связей по величине в аморфном окисле является тот факт, что тогда как плавление кристаллического кварца происходит при строго определенной температуре, т.е.энергия большинства связей одинакова, аморфное стекло SiO2 при нагревании до высоких температур размягчается постепенно.
Иллюстрация вводимых напряженной связью энергетических уровней
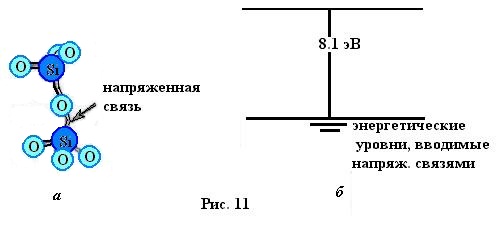
а -напряженная связь; б - вводимые ею энергетические уровни.
Напряженные связи могут легко оборваться, приводя, как и в кристаллическом кварце, к образованию электронно-дырочных пар. В результате возникают две ситуации:
1) электрон устремляется к зоне проводимости, а дырка - к валентной зоне;
2)электрон остается захваченным в экситонное состояние вблизи дна зоны проводимости и становится немобильным, а дырка захватывается на оборванную связь, причем между собой их связывает кулоновское поле. В последнем случае в запрещенной зоне возникает дополнительный (экситонный) уровень вблизи дна зоны проводимости ЕC (рис.12) [19].
При обрыве связей в аморфном SiO возникают нейтральные дефекты: акцепторные центры и центры, захватившие дырку, создающие донорный и акцепторный уровни в запрещенной зоне (рис.12) [19].
Оборванные Si-O связи могут восстанавливаться и таким образом снимать напряжения путем рекомбинации электронов и дырок, которые берутся или из экситонного состояния, или из зоны проводимости, или из нейтральных дефектов (рис.13.). При низких температурах процесс восстановления связей протекает слабо, но при T≈77К он усиливается, благодаря тепловому движению атомов [19].
Восстановление связей вызывает слабую релаксацию окружающей решетки, которая приводит к образованию двух локализованных уровней: донорного на 5.75 эВ выше потолка валентной зоны и акцепторного на 7.6 эВ ниже дна зоны проводимости (рис.13).
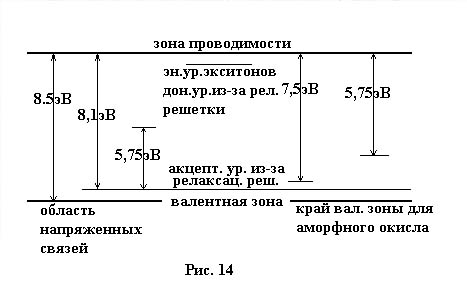
Общая схема распределения энергетических уровней, введенных в запрещенную зону SiO2 указанными дефектами [19], приведена на рис.14 .
Разрыв кремний-кислородной связи в а-SiO2 приводит к образованию комплементарных (способных рекомбинировать при встрече) дефектов - трехкоординированного атома кремния и немостикового кислорода [9]. Первый из них представляет собой
Общая схема уровней энергии, введенных в запрещенную зону аморфного SiO2 некоторыми дефектами.
кремнийобогащенный, второй кислородообогащенный дефект. Оба эти дефекта связаны с сеткой стекла, и ожидается, что их концентрации будут иметь близкие значения в разных процессах генерации и разрушения собственных дефектов в идеальной аморфной сетке [19]. Реакция образования трехкоординированного атома кремния и немостикового кислорода в процессе роста окисла записывается в виде [25-27]:
 (1)
(1)
где * электрон с неспаренным спином .
Процесс разрыва связи в материалах, имеющих аморфную структуру, энергетически отличается от процесса образования пары вакансия межузельный атом в соответствующих кристаллах. В работе [28] в рамках представлений о почти ионном характере связи металл-кислород были рассчитаны энтальпии образования сеточных дефектов для аморфных анодных окислов Al2O3 и Ta2O5 . Полученные значения составляли 1.2 и 3.4 эВ, соответственно, тогда как для кристаллического окисла Al O величина энтальпии образования дефектов Френкеля составляет 8.7 эВ [26, 28]. Аналогичная оценка энтальпии образования сеточных дефектов в стеклообразном SiO2 дает ≈5 эВ [26]. Это значение выше соответствующих данных для аморфных Al2O3 и Ta2O5 вследствие более низкой диэлектрической постоянной для SiO2. Возможно также, что подход Dignam M.Y. [28] не очень применим к случаю SiO2, так как связь Si-O носит ярко выраженный ковалентный характер.
С другой стороны, энтропия S образования сеточных дефектов в стеклообразном SiO2 значительно меньше энтропии образования точечных дефектов в кристаллах [26]. Энтропия образования сеточных дефектов с концентрацией ≈1020 см-3 в аморфном SiO2, была оценена как 0.1 кал/моль/K, что много ниже соответствующих значений как для ковалентных (8-15 кал/моль/К), так и для ионных (2-8 кал/моль/К) кристаллов. Причиной низкого значения энтропии считается структурная гибкость Si-O-Si связи, позволяющая протекать перераспределению структуры вокруг дефекта без разрыва связей. Энтропия образования сеточного дефекта на порядок ниже энтропии перехода кристалл-стекло (1 кал/моль/К). В результате низкого значения энтропии, в свободной энергии G образования сеточных дефектов в стекловидном SiO2 преобладает энтальпийный вклад [26], так что для SiO2 для температуры T=1000 К
G =H-TS=(5-0.004) эВ.
Следовательно, значение свободной энергии будет велико, даже если вклад энтальпии будет значительно меньше, чем грубые оценки, полученные путем рассмотрения SiO2 как твердого тела с ионным типом связи. Как результат такого большого значения свободной энергии, плотность сеточных дефектов в аморфном SiO2 пренебрежимо мала: даже в термически выращенных пленках она составляет всего 1016см-3 [26].
Малость величины S по сравнению с кристаллами должна приводить к тому, что концентрация точечных дефектов в аморфных материалах не должна зависеть от температуры, что и наблюдается в стекле SiO2[19,26].
Указанные выше дефекты могут взаимодействовать между собой, приводя к образованию различных агрегатов комплексных дефектов структуры [19].
Таким образом, дефекты, возникающие в аморфном SiO2 в результате обрыва связей, подразделяют на три группы: кислородные, кремниевые и комплексные.
Группа дефектов, отнесенная к кислородным
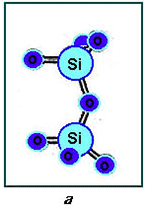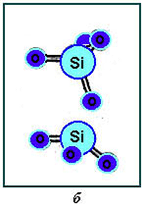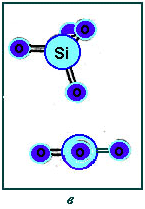
В сетке "совершенного" стеклообразного SiO2, так же как и в решетках α и β-кварца, атом кислорода всегда связан с кремниевыми атомами и рассматривается как мостиковый между двумя тетраэдрами (рис.15 а) [19,29]. В несовершенном a-SiO2 атомы кислорода могут оказаться в междоузельных положениях сетки, ослабляя или уничтожая связь между двумя тетраэдрами. В первом случае кислород называют немостиковым (рис.15 б), во втором - междоузельным (рис.15 в) [19,29].
Немостиковый кислород является основным сеточным дефектом в а-SiO2 . В пленках a-SiO2 он возникает в процессе их роста, а также генерируется при внешних воздействиях, в частности, при облучении.
Мостиковый (а), немостиковый (б) и междоузельный (в) кислород в аморфном окисле SiO2
Однако так как кислород всегда готов принять электрон (е), чтобы заполнить внешнюю валентную оболочку, он может образовывать отрицательно заряженный точечный дефект следующего типа [26,29]:
 (2)
(2)
Таким образом, немостиковый кислород представляет собой мелкую акцепторную ловушку с двумя возможными зарядовыми состояниями (0,-1), создающую в запрещенной зоне уровень ЕT , близкий к ЕС. Дефекты типа немостикового кислорода проявляют, однако, амфотерный характер, так как они могут также захватывать дырки на 2р-орбиталь кислорода, образуя донорную ловушку и создавая в запрещенной зоне уровень ЕТ , близкий к ЕV[19].
В этом случае [26]
 (3)
(3)
Междоузельный кислород (OМ) - атом О, который не связан с сеткой (рис.15 в). Он является амфотерным центром, так как возможны два типа захвата:
1 - междоузельный кислород может вести себя как акцепторный центр с двумя возможными зарядовыми состояниями ( 0 и -1), поскольку он имеет сродство к электрону
 (4)
(4)
Однако захваченный электрон слабо связан с таким центром в SiO2 , и энергия активации освобождения его много ниже сродства к электрону. Этот уровень скорее можно рассматривать как резонансный уровень в зоне проводимости, чем как локализованное состояние в запрещенной зоне.
2 - междоузельный кислород может вести себя как донорный центр: два зарядовых состояния (0 и +1).
 (5)
(5)
Донорный уровень должен быть совсем глубокий, так как энергия связи электрона с ионом кислорода велика (-14 эВ) и соответствующий энергетический уровень лежит в валентной зоне [19].
Способность дефекта к захвату носителя характеризуется параметром, названным поперечным сечением захвата σо [19].Область экспериментальных значений σо - от 10-22 до 10-12 см2.Большое значение ширины области связано с зарядом, который дефект имеет перед захватом. Если дефект перед захватом имеет положительный заряд, а носителем является электрон, то захват обусловлен притяжением и поперечное сечение велико (10-12 см2). Для нейтральных дефектов σо представляет собой только поперечное сечение самого дефекта (10-16 см2). Если дефект заряжен отрицательно, а носителем является электрон, то захват называется отталкивательным, а σо мало (10-22 см2) [19].
Группа дефектов, отнесенная к собственным Si дефектам
В аморфном SiO2 различают три собственных дефекта, связанных с Si [19,29]:
кремниевая вакансия - VSi ;
междоузельный кремний - SiM;<
трехвалентный кремний Si3+ или Si .
И VSi , и SiM с большим трудом образуются в некристаллическом SiO2, чем в Si, так как энергия связи Si с ионами О выше, чем энергия Si-Si связи [19].
SiM может появиться в процессе окисления Si, когда ионизированный кислород, реагируя с Si, вызывает смещение атома Si в междоузельное положение. Подвижный атом SiM образуется, если связь между двумя О и SiM не возникает. Ожидается, что такой дефект будет в количестве одного атома Si на 1000 [19].
Восстановленная форма Si может быть записана как Si+3. Она может возникнуть во время окисления или во время высокотемпературной обработки в водороде. Si+3 также играет роль в образовании некоторых примесных дефектов, которые будут рассмотрены ниже, и представления о нем используются в целом ряде моделей, описывающих захват и освобождение носителей заряда. Он ведет себя как донорный центр, реакция освобождения электрона которым имеет вид [26,29,30]:
 (6)
(6)
Комплексные дефекты в а-SiO2
Образование двух трехкоординированных атомов кремния в результате удаления кислорода из сетки вызывает развитие релаксационных процессов в системе, которые приводят к развороту тетраэдров, такому, что расстояние между указанными атомами Si уменьшается с 3.06 до 2.5 Аo [29]. Последнее расстояние только немного больше расстояния 2.35 Аo между атомами в чистом кристаллическом кремнии. Возникает Si-Si связь с энергией 1.83 эВ [19], стабилизирующая данный комплекс. Дефект такого типа называют кислородной вакансией и обозначают Si-Si -. Кислородная вакансия (кремний-кремниевая связь) должна иметь локальный уровень в запрещенной зоне, но он расположен настолько близко к дну зоны проводимости, что маскируется большой плотностью экситонных состояний [19].Этот комплекс может захватывать дырку, создавая дефект, аналогичный Е’-центру в кристалле. Е’-центр наиболее изученный дефект (особенно методами электронно-спинового резонанса) в α-кварце и α–SiO2 . Его можно рассматривать как релаксировавшую кислородную вакансию, захватившую дырку [10]. При этом один из трехкоординированных атомов Si с неспаренным спином остается в тетраэдрической конфигурации и ассоциируется с другим трехкоординированным атомом кремния без электрона, который из-за этого смещается в плоскость трех атомов кислорода, оставшихся от тетраэдра (рис.16), релаксируя к плоской тригональной конфигурации [30].
Хотя для разрыва Si-O-Si связи требуется энергия 7.9 эВ, для образования Е’-центра необходима энергия всего 5.8 эВ. Для объяснения такого расхождения была предложена трехступенчатая модель, которая проиллюстрирована на рис.16.
Кислородную вакансию в общем случае обозначают символом Vo. Однако, как уже указывалось раньше, кислород может быть мостиковым и немостиковым, поэтому его вакансия может быть также типа Vоп с обозначением Siо, когда немостиковый кислород удаляется из сетки. В этом случае в запрещенной зоне теоретически должны появиться два уровня энергии. Однако положение этих двух уровней зависит от расстояния, разделяющего два атома кремния. Энергетическое расстояние между двумя этими уровнями, полученное на основе большой кластерной модели [10], составляет 6.6 эВ. Экспериментально один тип вакансии не может быть отделен от другого.
Кислородная вакансия в аморфном SiO2 - дефект, аналогичный Е’-центру в кристалле, и модель, предложенная для оптического поглощения и люминесценции [19]
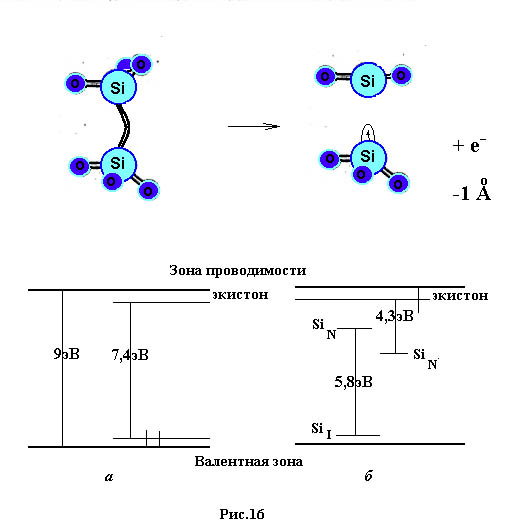
а - нейтральная кислородная вакансия (SiN) Е’-центр, образовавшийся при удалении атома О; (б) ионизированная кислородная вакансия (SiI), стабилизированная за счет асимметричной релаксации двух соседних атомов кремния).
При высоких температурах (Т >500oС) кислородные вакансии могут мигрировать под действием электрического поля по направлению к поверхности раздела с Si, где они нейтрализуются.
Модель кислородных вакансий очень перспективна в плане объяснения источника фиксированного (пограничного) заряда в окисле [10].
Комплементарной парой для кислородной вакансии (кремний-кремниевой связи) является пероксидный мостик - комплекс из двух немостиковых атомов кислорода [19,26,31] (рис.17а). Реакция образования такого дефекта записывается в виде [26]: <
 (7)
(7)
Энергия кислород-кислородной связи в этом случае составляет 1.44 эВ [19].
Теоретически [31] показано, что в пределах расстояний между двумя атомами кремния 3.2 - 5.2 А в сетке стекла существуют такие взаимные ориентации, при которых связь между ними при помощи пероксидного мостика энергетически более вы годна, чем связь посредством мостикового кислорода. Пероксидные мостики создают в запрещенной зоне заполненный уровень на расстоянии 3.4 эВ выше потолка валентной зоны [10].
В стехиометрическом образце концентрации пероксидных мостиков и кремний-кремниевых связей (кислородных вакансий) должны быть равны. В реальных образцах, как правило. имеющих дефицит кислорода, концентрация пероксидных мостиков ниже, чем концентрация комплементарных им кислородных вакансий [10].
Ионизированную форму пероксидного мостика обозначают -Si-O-O-- и называют пероксидным радикалом [10,17,31] (рис.17 б). Его можно рассматривать как сложный агрегат, состоящий из немостикового атома кислорода и присоединеного к нему междоузельного атома кислорода. На пероксидном радикале локализован неспаренный электрон [10,26].
Модель пероксидных дефектов в чистом a-SiO2.
а - пероксидный мостик; б - пероксидный радикал. Вертикальные стрелки указывают на наличие электронов с неспаренным спином, пунктиром указаны их орбитали.
Исследования халькогенидных стекол показали, что для объяснения экспериментальных данных необходимо ввести понятие о парах заряженных дефектов в некристаллических веществах [17,20,32,33], которые образуются в результате перераспределения заряда между концами оборванных связей (элементарными дефектами) и спаривания электронов. Поскольку изменение зарядового состояния атомов сетки можно трактовать как изменение их валентности, они были названы парами с переменной валентностью (ППВ) [10,20].
В работах [10,33] было высказано предположение, что дефектами типа ППВ в аморфном SiO2 являются отрицательно заряженные немостиковые атомы кислорода и положительно заряженные трехкоординированные атомы кремния. Последние могут быть частично (слабо) связаны со стоящими рядом двухвалентными мостиковыми атомами кислорода [20].
Несколько иная модель дефектов типа ППВ предложена в работах [34-36]: если для отрицательно заряженного немостикового атома кислорода остается прежняя конфигурация, то положительно заряженный трехкоординированный кремний образовывает сильную связь с мостиковым атомом кислорода, так что тот становится немостиковым и положительно заряженным (О+3). Оценки энергии таких дефектов дают величину порядка 2 эВ, и поэтому ожидается, что их концентрации будут 1019 см-3, если температура стеклования ≈1500 К [10].
Наряду с ППВ в [32,33] были введены дефекты, которые назвали ассоциированными парами с переменной валентностью (АППВ) [10]. В модели АППВ предполагается, что один из атомов
Si, находящийся в ближайшей координационной сфере атома О+, непосредственно (с другой стороны) связан с отрицательно заряженным немостиковым атомом кислорода.
Поскольку при создании агрегатных дефектов между входящими в них элементарными дефектами образуются химические связи, то присутствие агрегатов энергетически более выгодно, чем присутствие отдельных элементарных дефектов.
При обычных режимах получения аморфных окислов равновесные концентрации собственных дефектов как правило оказываются ниже предела чувствительности методов их изучения [10] (около 1014 см-3). Сигнала ЭПР тоже нет.
Генерация элементарных дефектов в концентрациях, достаточных для их экспериментального изучения, может быть осуществлена при дополнительных внешних воздействиях, переводящих электронную или атомную подсистему в более неравновесные состояния. Один из способов такого воздействия - радиационное облучение материалов, в процессе которого могут генерироваться сеточные дефекты с большой плотностью. При этом для образования сеточных дефектов требуется бомбардировка частицами с меньшими энергиями, чем для создания точечных дефектов в аналогичных кристаллах [10]. Поскольку высокотемпературные собственные дефекты, даже будучи спектроскопически неактивными, являются предшественниками радиационных дефектов, изучение последних позволяет сделать косвенные выводы о концентрации и типе термических дефектов в исходном материале.